Diabetes mellitus Typ 1
Endokrinologie und Diabetologie
Steckbrief
Der Typ-1-Diabetes ist eine Autoimmunerkrankung, die durch einen absoluten Insulinmangel gekennzeichnet ist. Sie macht in Europa über 90% der Diabetesfälle im jungen Lebensalter (unter 25 Jahren) aus. Durch Bestimmung der diabetesassoziierten Antikörper oder genetischer Marker lassen sich in der Bevölkerung Individuen mit einem hohen Erkrankungsrisiko für Präventionsstudien zuverlässig identifizieren. Eine Insulintherapie soll umgehend nach Diagnosestellung des Typ-1-Diabetes eingeleitet werden, da sich eine potenziell lebensbedrohliche diabetesbedingte Ketoazidose rasch entwickeln kann. Der Behandlungsstandard ist die intensivierte Insulintherapie mit mehreren täglichen Insulininjektionen bzw. einer Insulinpumpe. Technische Hilfsmittel wie eine kontinuierliche Glukosemessung bis hin zu teilautomatisierten, rückgekoppelten Systemen (sog. H) gewinnen zunehmend an Bedeutung in der Routinetherapie.
Synonyme
- insulinpflichtiger Typ-1-Diabetes
- IDDM (Insulin-dependent Diabetes mellitus; dieser Begriff ist jedoch veraltet)
- Zuckerkrankheit
Keywords
- Insulin
- Insulinpumpe
- kontinuierliche Glukosemessung
- HbA1c
- Zeit im Zielbereich
Definition
- Diabetes mellitus ist eine Stoffwechselerkrankung, charakterisiert durch eine chronische Hyperglykämie als Resultat einer fehlenden Insulinsekretion, einer gestörten Insulinwirkung oder beidem.
- Beim Typ-1-Diabetes liegt ein Insulinmangel vor.
Epidemiologie
- In Europa wird ein sogenanntes Nord-Süd-Gefälle mit den höchsten jährlichen Inzidenzraten in Finnland (64,2 Neuerkrankungen pro 100000 Kinder im Alter von 0–14 Jahren) und den niedrigsten Inzidenzraten in Mazedonien (5,8 Neuerkrankungen pro 100000 Kinder) beobachtet.
- Dabei gibt es aber auch Ausnahmen, z.B. die sehr hohe Diabetesinzidenzrate auf Sardinien (54,4 Neuerkrankungen pro 100000 Kinder).
- Seit Jahrzehnten wird eine stetige Zunahme der jährlichen Inzidenz von ca. 3–4% in den Altersgruppen 0–14 Jahre beobachtet, wobei die Inzidenz in der Gruppe der Vorschulkinder zwischen 5% und 7% liegt.
- Die epidemiologischen Daten in der Gruppe der jungen Erwachsenen (15–19 Jahre) variieren ebenso stark, mit der niedrigsten Inzidenz in Mauritius (1,1 Neuerkrankungen pro 100000 Personen pro Jahr) und der höchsten Inzidenz in Estland (39,9 Neuerkrankungen pro 100000 Personen).
- Auch in der Gruppe der 70- bis 79-Jährigen zeigt die jährliche Typ-1-Diabetesinzidenz eine große Variation: 0,8 Neuerkrankungen pro 100000 Personen in Navarra, Spanien, vs. 55 Neuerkrankungen pro 100000 Personen in Kronoberg, Schweden.
Häufigkeit
- Die errechnete bundesweite Inzidenz des Typ-1-Diabetes liegt aktuell bei 22,9 Neuerkrankungen pro 100000 Kinder im Alter von 0–14 Jahren.
- 1 Kind von 675 Kindern erkrankt an Typ-1-Diabetes.
- In Deutschland leben zwischen 15600 und 17400 Kinder und Jugendliche (0–14 Jahre) bzw. ca. 300000 Menschen mit Typ-1-Diabetes.
Altersgipfel
- Während des ersten Lebensjahres tritt der Typ-1-Diabetes selten auf.
- Eine Diabetesmanifestation vor dem 6. Lebensmonat weist auf eine monogenetische Diabetesform hin (z.B. neonataler Diabetes).
- Die Inzidenz des Typ-1-Diabetes nimmt mit dem Alter zu und erreicht einen kleineren Häufigkeitsgipfel um das 4. Lebensjahr, einen sehr viel ausgeprägteren Gipfel zwischen dem 10. und 12. Lebensjahr.
Geschlechtsverteilung
- Jungen und Mädchen sind gleich häufig betroffen.
- Jenseits des 15. Lebensjahres gibt es eine Geschlechterwendigkeit (Männer > Frauen; Mann-Frau-Ratio 1,47 [95% Konfidenzintervall 1,33–1,60]).
Prädisponierende Faktoren
- Obwohl Personen mit an Typ-1-Diabetes erkrankten erstgradigen Verwandten ein höheres Risiko haben, dass sich bei ihnen selbst ein Diabetes entwickelt, weisen 9 von 10 Neuerkrankte keine positive Familienanamnese für Typ-1-Diabetes auf.
Ätiologie und Pathogenese
- Der Typ-1-Diabetes entsteht durch eine immunvermittelte Zerstörung der insulinproduzierenden Betazellen der Bauchspeicheldrüse. Dieser Prozess ist multifaktoriell (Abb. 10.1). Der Typ 1 Diabetes beginnt mit der Autoimmunität, dem Nachweis von 2 oder mehr persistierenden diabetesassoziierten Antikörpern (Stadium 1). Eine zusätzliche subklinische Dysglykämie wird als Stadium 2 bezeichnet, der manifeste Diabetes als Stadium 3.
- Neben bislang nicht eindeutig identifizierten Umweltfaktoren spielen genetische Faktoren für die Initiierung dieser Fehlregulierung des Immunsystems eine Rolle.
- Den weitaus größten Einfluss haben Gene der MHC-Region (Major Histocompatibility Complex), insbesondere HLA-DR und HLA-DQ.
- Die Genotypen HLA DR3-DQ2/DR4-DQ8 und HLA DR4-DQ8/DR4-DQ8 sind mit dem höchsten Diabetesrisiko assoziiert.
- Die bedeutendsten Nicht-MHC-Gene sind das Insulingen INS VNTR und PTPN22.
- Betazellautoimmunität kann durch den Nachweis von Autoantikörpern im Serum oder Plasma diagnostiziert werden.
- Etablierte Betazellautoantikörper bei Typ-1-Diabetes sind (Pro-)Insulinautoantikörper und Autoantikörper gegen Glutamatic Acid Decarboxylase 65 (GAD65), das Insulinoma-assoziierte Antigen 2 (IA-2) und den Zink-Transporter 8 (ZnT8).
- Betazellautoantikörper werden bei klinischer Manifestation des Typ-1-Diabetes bei etwa 90% aller Patienten festgestellt.
- Ein Inzidenzgipfel für das Auftreten der Antikörper findet sich bereits zwischen dem ersten und zweiten Lebensjahr.
- Bei Kindern und Jugendlichen mit multiplen – d.h. zwei oder mehr – der genannten Betazellautoantikörper, entwickelt sich mit nahezu 100%iger Wahrscheinlichkeit einen insulinpflichtigen Typ-1-Diabetes innerhalb von 15 Jahren nach Serokonversion.
- Die Fortschritte der genetischen und immunologischen Diagnostik erlauben eine Frühdiagnose in allen 3 Stadien als Grundlage für neuartige immunmodulatorische Therapieansätze in Risikopopulationen (siehe: www.gppad.ord, www.innodia.eu).
Abb. 10.1 Betazellmasse im Verlauf des Typ-1-Diabetes und diagnostische Möglichkeiten.
Klassifikation und Risikostratifizierung
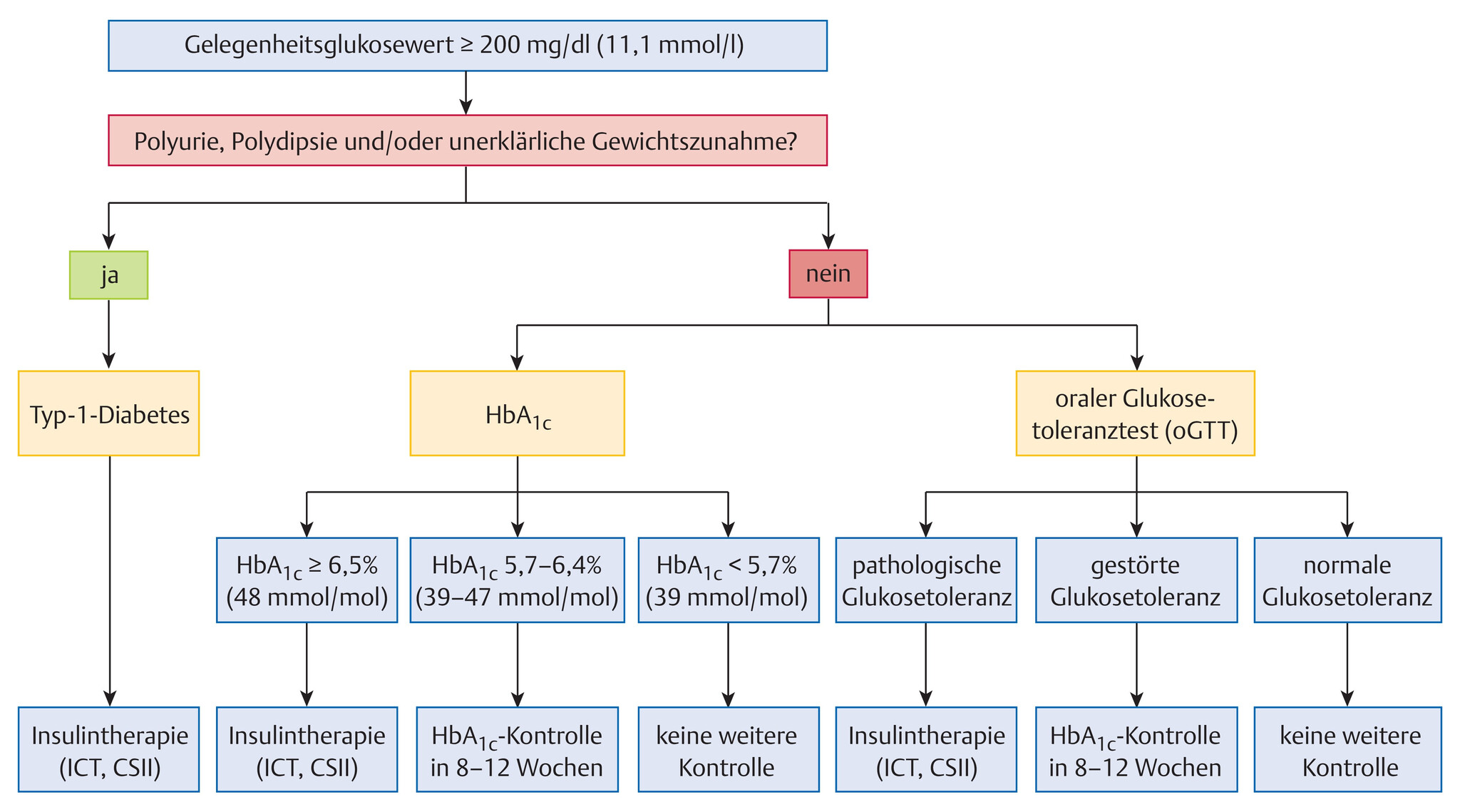
- Folgende Kriterien liegen der Diagnose eines behandlungsbedürftigen Diabetes mellitus zugrunde:
- typische Symptome und eine Plasmaglukosekonzentration von ≥200mg/dl (11,1mmol/l), unabhängig vom Zeitpunkt der Nahrungsaufnahme
- Nüchtern-Plasmaglukose ≥126mg/dl (7,0mmol/l); nüchtern: Phase ohne jegliche Kalorienzufuhr für mindestens 8 Stunden
- 2-h-Plasmaglukose-Wert von ≥200mg/dl (11,1mmol/l) im oralen Glukosetoleranztest (oGTT), durchgeführt nach den Vorschriften der Weltgesundheitsorganisation (WHO)
- Dem Belastungstest sollte in jedem Fall eine mindestens dreitägige Phase isokalorischer, normal kohlenhydrathaltiger Ernährung vorausgehen.
- Die Glukosebelastung erfolgt nach Verabreichung von 1,75 g pro kg Körpergewicht einer Oligosaccharidlösung (maximal 75g), die innerhalb von 3–5 Minuten getrunken werden muss.
- HbA1c-Wert ≥6,5% (48mmol/mol Hb), wobei ein HbA1c <6,5% das Vorliegen eines Diabetes mellitus nicht ausschließt
- Jedes der obigen Kriterien muss am folgenden Tag durch eine weitere Untersuchung bestätigt werden, wenn nicht eine deutliche Hyperglykämie oder typische Symptome vorliegen.
- Eine gestörte Glukosetoleranz liegt vor, wenn
- der Nüchtern-Glukosewert zwischen 100–125mg/dl (5,6–6,9mmol/l) oder
- der 2-Stunden-Glukosewert zwischen 140–199mg/dl (7,8–11,0mmol/l) im Plasma liegt.
Symptomatik
- Polyurie, Polydipsie und/oder Gewichtsabnahme
- Bei Kindern können Symptome wie sekundäre Enuresis nocturna, Leistungsabfall in der Schule mit oder ohne Konzentrationsschwäche hinweisend sein.
- Übelkeit, Erbrechen, Bauchschmerzen, Kussmaul’sche Atmung, Bewusstseinseintrübung oder Koma sind Symptome einer diabetischen Ketoazidose (DKA).
- Je jünger die Kinder, desto schneller entwickelt sich eine DKA; bis zu 50 Prozent der Kinder im Vorschulalter manifestieren einen Typ-1-Diabetes bereits im Stadium der DKA.
| Cave Eine sekundäre Verschlechterung, wie Kopfschmerzen, Herzfrequenzabnahme, neurologische Veränderungen (Unruhe, Irritabilität, Bewusstseinstrübung, Eintrübung), Blutdruckanstieg oder SaO2-Abfall im Rahmen einer diabetischen Ketoazidose, weist auf eine zerebrale Krise hin, die bei einer frühzeitigen, gegebenenfalls (nach 30min) wiederholten, intravenösen Mannitolgabe (0,5–1g/kg) über 10–15min eine deutlich bessere Prognose hat. |
Diagnostik
Diagnostisches Vorgehen
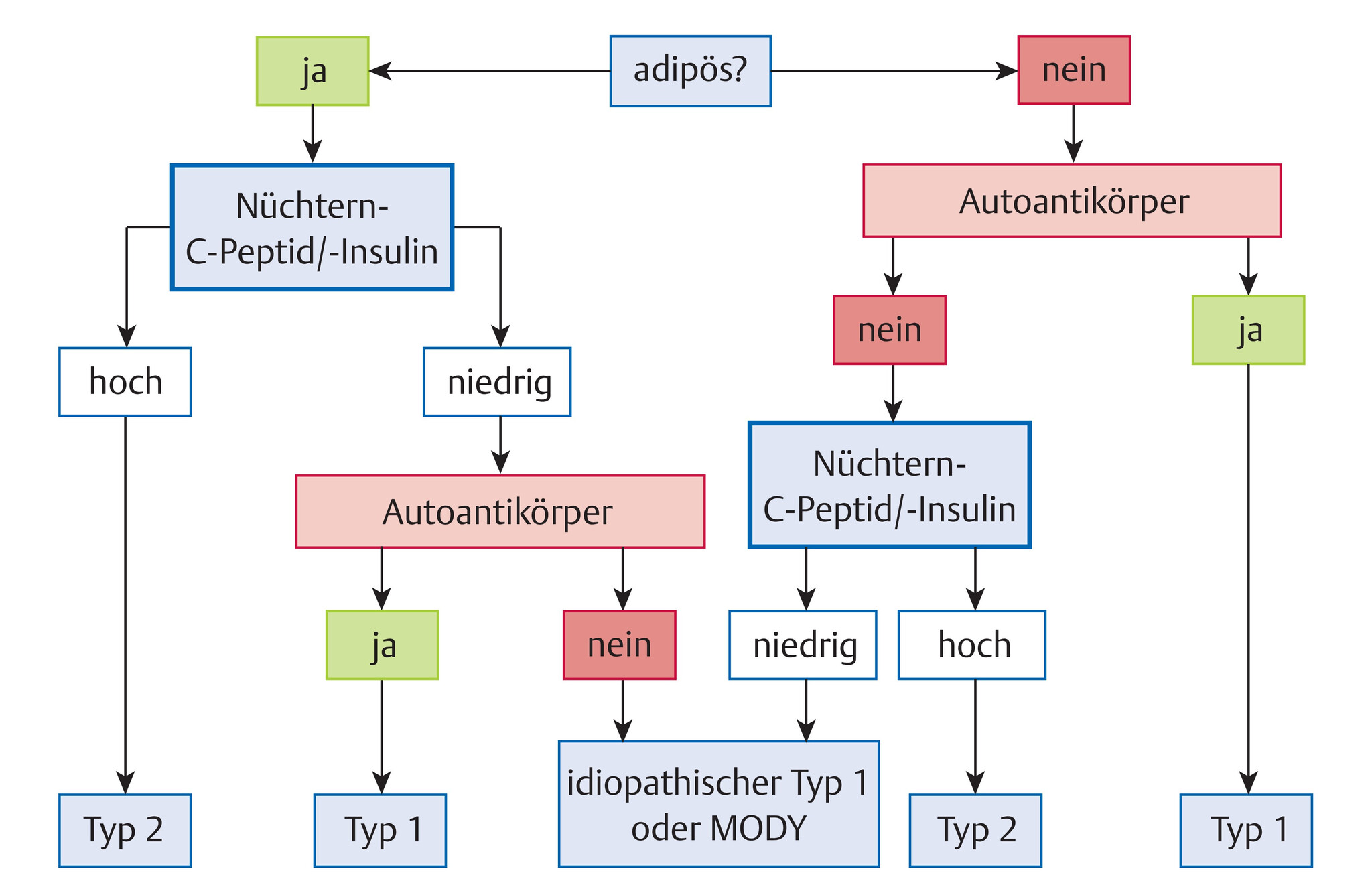
- Die Diagnose eines Typ-1-Diabetes basiert auf
- der Bestimmung der Glukosekonzentration im Blut und
- der Präsenz von klinischen Symptomen wie Polyurie, Polydipsie und/oder Gewichtsverlust (Abb. 10.2).
- In seltenen Fällen kann die Durchführung eines oralen Glukosetoleranztests (oGTT) hinzugezogen werden.
Abb. 10.2 Diagnostischer Algorithmus für Diabetes mellitus bei Kindern. MODY: Maturity Onset Diabetes of the Young.
Anamnese
-
diabetestypische Symptome wie Polyurie, Nykturie, Polydipsie, Gewichtsabnahme
-
Familienanamnese (Typ-1-Diabetes, Typ-2-Diabetes, Gestationsdiabetes, weitere Autoimmunerkrankungen wie Autoimmunthyreoiditis, Morbus Addison, perniziöse Gastritis, multiple Sklerose, rheumatoide Arthritis, Vitiligo etc.)
Körperliche Untersuchung
- internistischer Status
- Hautinspektion und Untersuchung der Insulininjektionsstellen (Lipohypertrophie, Lipoatrophie)
- erwachsene Patienten bzw. Diabetesdauer länger als 10 Jahre: Neuropathiestatus (z.B. Neuropathie-Defizit-Score)
Labor
- Blutglukose, HbA1c
- C-Peptid bei differenzialdiagnostischen Zweifelsfällen zu anderen Diabetestypen (Abb. 10.2)
- bei Manifestation: diabetesassoziierte Autoantikörper: Insulinautoantikörper (IAA), Autoantikörper gegen Glutaminsäuredekarboxylase (GADA), Autoantikörper gegen Tyrosinphosphatase IA-2 (IA2A), Autoantikörper gegen Zinktransporter 8 (Zn8A)
- bei DKA: Blutgasanalyse, Natrium, Kalium, Chlorid, Kalzium, Magnesium, Phosphat, Harnstoff, Kreatinin, CRP, Lipase
- Cave bei Hyperglykämie: korrigiertes Natrium=gemessenes Natrium + 2 × [(Glukose–100)]:100]
- ggf. MODY-Diagnostik im Verlauf
Differenzialdiagnosen
-
Die Differenzierung zwischen den verschiedenen Diabetestypen (Typ-1-Diabetes, Typ-2-Diabetes, monogenetisch bedingter Diabetes etc.) hat besondere Bedeutung sowohl für die Therapie als auch für die Schulung und Beratung der Patienten und ihrer Familien (Tab. 10.5).
|
neonataler Diabetes |
|
|
MODY (Maturity Onset Diabetes of the Young) |
Manifestation vor dem 25. Lebensjahr, negative diabetesassoziierte Autoantikörper, niedriger Insulinbedarf trotz längerer Diabetesdauer (>1 Jahr), häufig positive Familienanamnese |
|
Typ-2-Diabetes |
Übergewicht/Adipositas, positive Familienanamnese für Typ-2-Diabetes, Acanthosis nigricans, negative diabetesassoziierte Autoantikörper |
Therapie
- Unabhängig vom Diabetestyp muss bei jedem Patienten mit deutlicher Hyperglykämie, Dehydratation und metabolischer Entgleisung im Sinn einer Ketoazidose zunächst eine Insulintherapie begonnen werden.
- Der Behandlungsstandard bei Patienten mit Typ-1-Diabetes ist die intensivierte Insulintherapie (ICT) nach dem Basis-Bolus-Prinzip, da sie das physiologische Insulinsekretionsmuster bei Stoffwechselgesunden imitiert (Abb. 10.3).
- Bei fehlender Zielwerterreichung und Wunsch des Patienten kann eine Umstellung auf ein AID-System erwogen werden.
Abb. 10.3 Therapeutischer Algorithmus bei Diabetes mellitus Typ 1. CSII: Continuous Subcutaneous Insulin Infusion; ICT: intensivierte Insulintherapie.
Therapeutisches Vorgehen
- Bei der ICT wird der nahrungsabhängige Prandialinsulinbedarf durch die Injektion von Normalinsulin oder einem schnellwirksamen Insulinanalogon vor den Mahlzeiten gedeckt, der nahrungsunabhängige Basalinsulinbedarf durch die Injektion von NPH-Insulin oder einem langwirksamen Insulinanalogon ein- oder mehrmals am Tag.
- Bei der differenzierten Prandial- und Basalinsulinsubstitution der intensivierten Insulintherapie besteht etwa 70% der Tagesdosis aus Prandial-, etwa 30% aus Basalinsulin.
- Die Insulinpumpentherapie (CSII: Continuous Subcutaneous Insulin Infusion) wird vermehrt zur Behandlung von Patienten mit Typ-1-Diabetes eingesetzt.
- Bei Kindern im Vorschulalter ist sie die Therapie der 1. Wahl bereits ab Manifestation der Erkrankung.
- Bei Manifestation des Typ-1-Diabetes ist der Insulinbedarf zunächst relativ hoch. Bei Patienten mit ausgeprägter Dehydratation und Ketoazidose liegt er zwischen 1,5 und 2,5 IE pro kg Körpergewicht (KG), bei Kindern mit mittelgradiger Dehydratation ohne Ketoazidose zwischen 1,0 und 1,5 IE pro kg KG und bei der leichten Manifestationsform mit geringgradiger Dehydratation zwischen 0,5 und 1,0 IE pro kg KG.
- Bei etwa 90 Prozent der Patienten kann die Insulindosis einige Tage bis zu 4 Wochen nach Beginn der Behandlung nach und nach reduziert werden. Als „partielle temporäre Remission“ wird die Phase bezeichnet, in der der Insulintagesbedarf definitionsgemäß weniger als 0,5 IE pro kg KG beträgt.
- Die Insulin-Dosisanpassung umfasst
- (1) die im Rahmen intensivierter Therapieformen (ICT, CSII) regelmäßig erfolgende Anpassung der Prandialinsulindosis an die aktuellen Glukosewerte und die geplante Mahlzeit, aber auch
- (2) eine Adaptation der Insulintherapie im Rahmen besonderer körperlicher Begebenheiten (z.B. bei einem Infekt, vor dem Sport etc.).
- Es gibt für Patienten mit Typ-1-Diabetes keine „Diabetesdiät“, sondern eine Ernährung, die möglichst gut abgestimmt ist mit ihrer aktuellen Wachstumsphase, ihrem persönlichen Energiebedarf, ihrer körperlichen Aktivität und den Gewohnheiten der Familie.
- Da die Glukosewirkung von Nahrungsmitteln nicht nur von dem enthaltenen Anteil an Kohlenhydraten, sondern auch von anderen Faktoren, wie Art der Kohlenhydrate, Fettgehalt, Ballaststoffanteil, Magenfüllung etc., beeinflusst wird, ist eine grammgenaue Berechnung von Kohlenhydraten ernährungsphysiologisch nicht begründbar.
- Zur Therapiekontrolle lösen die Systeme zur kontinuierlichen Glukosemessung (CGM) die punktuelle Selbstmessung der Blutglukose ab.
- Sensoren von Systemen zur kontinuierlichen Messung (CGM: Continuous Glucose Monitoring) liegen im Unterhautfettgewebe und messen Glukose durch Lichtquellen oder durch ein elektrisches Signal.
- Die ermittelten Werte werden drahtlos auf das entsprechende Display des Sensorsystems übertragen.
- Neben dem Glukosewert wird einen Trendpfeil angezeigt, der die Richtung und die Geschwindigkeit der Glukosekonzentrationsänderung anzeigt und bei Über- oder Unterschreiten definierter Grenze einen Alarm gibt.
- Das Flash Glucose Monitoring (FGM) ist ein alleinstehendes Gewebsglukosemesssystem ohne Alarmmeldungen für die Hypo- und Hyperglykämie.
- Mit einem Lesegerät, welches auch als Blutzuckermessgerät genutzt werden kann, wird über den Sensor gescannt.
- Damit erscheint der aktuelle Gewebsglukosewert bei Bedarf mit dem dazugehörigen Trendpfeil.
- Es erfolgt die Beurteilung der Zeit im Zielbereich (70-180mg/dl / 3.0-10.0 mmol/L (TIR) und der Zeit im hypoglykämischen Bereich (<70 mg/dl/ < 3.9 mmol/L).
- Komplementär zur Beurteilung der Langzeitstoffwechselkontrolle durch den HbA1c (Ziel < 7.0%/ wird eine TIR von > 70%.
- In einem AGP (ambulantes Glukoseprofil) ist die Abbildung der Glukosedaten aus mehrenen Tagen in Perzentilen erfasst. So kann ein systematischer Fehler in der Therapie der Insulindosierung erkannt werden.
- Eine Blutglukoseeigenmessung mithilfe geeigneter Blutzuckermessgeräte wird empfohlen, wenn Zweifel an der Einschätzung durch CGM bestehen.
- Die zulässige Genauigkeit von Blutzuckermessgeräten ist in der DIN EN ISO 15197 geregelt und verlangt in der neuesten Fassung von 2015, dass bei 95% aller Messwerte die Abweichung zu einem Referenzwert nicht mehr als 15mg/dl bzw. 0,8mmol/l (für Glukosewerte <100mg/dl bzw. 5,5mmol/l) bzw. 15% (für Messwerte ≥100 mg/dl bzw. 5,5mmol/l) beträgt.
- Bei bestimmten Stoffwechselsituationen (z.B. Infektionen, ausgeprägte Hyperglykämie, Übelkeit, Erbrechen, Durchfall, Hunger, Fasten) sollten Urin oder Blut auf Ketonkörper bzw. Betahydoxybutyrat untersucht werden.
- Eine strukturierte und qualitätsgesicherte Diabetesschulung ist ein integraler und unverzichtbarer Bestandteil jeder Diabetestherapie.
- Wiederholte, altersgerechte Schulungen auf der Basis des „Empowerment-Ansatzes“ sollen den Patienten und ihren Familien ein sachkundiges Selbstmanagement der Therapie ermöglichen. Folgende evaluierte deutschsprachige Schulungsprogramme stehen für Patienten mit Typ-1-Diabetes und ihren Eltern/Familien zur Verfügung:
- Kinder und Jugendliche mit Diabetes. Medizinischer und psychologischer Ratgeber für Eltern (zertifiziert durch die DDG)
- Delfin – das Schulungsbuch für Eltern von Kindern mit Diabetes
- Diabetes bei Kindern: ein Behandlungs- und Schulungsprogramm (für 6- bis 12-jährige Kinder mit Typ-1-Diabetes; DDG-zertifiziert und akkreditiert im Rahmen des DMP Typ-1-Diabetes)
- Diabetes bei Jugendlichen: ein Behandlungs- und Schulungsprogramm (akkreditiert im Rahmen des DMP Typ-1-Diabetes)
- SPECTRUM Schulungs- und Behandlungsprogramm zur kontinuierlichen Glukosemessung (CGM) für Menschen mit Typ-1-Diabetes
- PRIMAS – Leben mit Typ-1-Diabetes
- HyPOS Schulungskoffer – Unterzuckerungen besser wahrnehmen, vermeiden und bewältigen
- Neuros Schulungskoffer
- Auch weiteren Betreuern von Kindern mit Typ-1-Diabetes, z.B. Lehrkräften in der Grundschule, Erziehern und Erzieherinnen in Kindergarten, Hort und Krippe, soll eine Schulung angeboten werden.
Verlauf und Prognose
- Patienten mit Typ-1-Diabetes werden alle 8–12 Wochen ambulant betreut. Nach Manifestation der Erkrankung oder in besonderen Problemfällen sind Vorstellungen in kürzeren Abschnitten sinnvoll.
- Zur ambulanten Betreuung gehört die Erfassung und Dokumentation
- von Größe, Gewicht und Body-Mass-Index (Verzeichnen in geschlechtsbezogenen Perzentilenkurven),
- des Blutdrucks (1× pro Quartal) und
- des Pubertätsstadiums nach Tanner (jährlich bis zur Menarche bei Mädchen, bis zum Stimmbruch bei Jungen).
- Als Parameter zur Abschätzung des Risikos von Folgeerkrankungen des Typ-1-Diabetes hat sich das glykierte Hämoglobin A1c (HbA1c) bewährt.
- Ein HbA1c-Wert unter 7,0% (53mmol/mol Hb) wird angestrebt.
- Einmal jährlich sollten kleines Blutbild, Nierenretentionsparameter, Transaminasen und Gesamteiweiß sowie die Lipidparameter (Cholesterin, HDL-und LDL-Cholesterin, Triglyzeride) untersucht und dokumentiert werden.
- Bei Erreichen der Pubertät (>11 Jahre) bzw. bei einer Diabetesdauer länger als 5 Jahre erfolgt jährlich eine Augenhintergrunduntersuchung in Mydriasis und eine Bestimmung der Albuminausscheidung im Urin (Spontanurin als Screeningmethode oder Albuminexkretionsrate im Nachturin) zur Erfassung subklinischer Stadien einer diabetesbedingten Mikroangiopathie.
- Bei erwachsenen Patienten bzw. bei Diabetesdauer über 10 Jahre soll einmal pro Jahr der Neuropathiestatus erhoben werden.
- Bei Manifestation des Diabetes und in ein- bis zweijährlichen Abständen sollen ein Schilddrüsenfunktion- (fT4 und TSH) und Zöliakie-Screening (IgA-Antikörper gegen Gewebstransglutaminase) erfolgen, da Patienten mit Typ-1-Diabetes ein 5- bis 10-fach höheres Risiko haben, dass sich eine Autoimmunthyreoiditis oder eine Zöliakie entwickelt.
- In Einzelfällen kann auch das Vorliegen eines M. Addison oder einer perniziösen Anämie bei Patienten mit Typ-1-Diabetes in Betracht gezogen werden, insbesondere beim Vorliegen klinischer Symptome wie ungeklärte Hypoglykämien, Erbrechen, Elektrolytverschiebung, Hyperpigmentierung, Schwäche (M. Addison) oder einer therapieresistenten Gastritis (perniziöse Anämie).
- Dabei sollten folgende Parameter bestimmt werden: 8-Uhr-Kortisol und Nüchternglukose, Nebennierenrindenantikörper (M. Addison) bzw. Parietalzellantikörper (perniziöse Anämie).
Prävention
- Gegenwärtig gibt es keine etablierte Möglichkeit der Prävention des Typ-1-Diabetes.
- Die Ziele der Diabetes-Präventionsstudien sind:
- primäre Prävention: den Beginn des Autoimmunkrankheitsprozesses in einer gesunden Population ohne jegliche Anzeichen der Erkrankung zu verhindern
- sekundäre Prävention: Anhalten des Autoimmunprozesses bei Personen mit multiplen diabetesassoziierten Antikörpern
- tertiäre Prävention: Verzögerung des Krankheitsverlaufs und Stabilisierung der endogenen Insulinsekretion nach der klinischen Manifestation des Typ-1-Diabetes
Literatur
Literatur zur weiteren Vertiefung
-
[1] American Diabetes Association. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes – 2022. Diabetes Care. 2022 ;45 (Suppl. 1): S17-S38. doi: 10.2337/dc22-S002
Suche in: PubMed Google Scholar -
[2] Holt RIG, DeVries JH, Hess-Fischl A, et al. The management of type 1 diabetes in adults. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2021; 64: 2609-2652. doi: 10.1007/s00125-021-05568-3
Suche in: PubMed Google Scholar -
[3] Neu A, Beyer P, Bürger-Büsing J et al. Diagnosis, therapy and control of diabetes mellitus in children and adolescents. Exp Clin Endocrinol Diabetes 2014; 122: 425–434
Suche in: PubMed Google Scholar