Angeborene Störungen und Besonderheiten in der Pädiatrie (Diabetes mellitus)
Endokrinologie und Diabetologie
Steckbrief
Angeborene, monogenetische Diabetesformen werden bei Manifestation vor dem 6. Lebensmonat als neonataler Diabetes mellitus (im Sinn von angeboren) und gemäß dem weiteren, klinischen Verlauf als transienter (TNDM) oder permanenter neonataler Diabetes mellitus (PNDM) bezeichnet. MODY (Maturity Onset Diabetes of the Young) manifestiert sich jenseits des Kindesalters, in der Regel ab Pubertätsbeginn. Im Vergleich zu Diabetes mellitus Typ 1 sind diese genetischen Diabetesformen sehr selten. Die molekulargenetische Diagnose ermöglicht eine individuelle, genetische Beratung der Familien sowie eine möglichst zielgerichtete Diabetestherapie, die auch oral mit Glibenclamid (Sulfonylharnstoff), und damit weniger intensiv und komplikationsbehaftet ausfallen kann. Familiäre, monogenetische Diabetesformen sind entweder dominant, rezessiv oder mitochondrial vererbt; gelegentlich können auch De-novo-Mutationen auftreten. Die entsprechenden Gendefekte verursachen eine abnorme Pankreas- und Inselentwicklung, gestörte Insulinsekretion oder selten auch Insulinresistenz. Begleitende Erkrankungen der Niere, des ZNS, der Lunge oder des Herzens sind möglich.
Aktuelles
Was gibt es Neues?
Seit der letzten Auflage wurden in Einzelfällen neue, monogenetische Diabetesformen bzw. -syndrome bei Mutationen in TRMT10A, DNAJC3, CNOT1, YIPF5, EIF2B1 oder ONECUT1 beschrieben. Um mit der Diagnostik keine unnötige Zeit zu verlieren, wird eine NGS-Diagnostik mittels aktuellem Diabetespanel empfohlen. Die Klassifikation gefundener Mutationen sollte sich an den 2015 veröffentlichten ACMG/AMP-Leitlinien orientieren[2].
Kinder mit neonatalem Diabetes durch Mutationen des ATP-abhängigen Kaliumkanals (KATP), also der Gene ABCC8 und KCNJ11, zeigen teilweise auch neurologische Auffälligkeiten (das sog. DEND-Syndrom); dies gilt jetzt auch für ABCC8-Mutationsträger. [1]
Ein relevanter Anteil Jugendlicher mit klinischer Diagnose Typ-2 Diabetes trägt pathogene MODY-Mutationen (~4,5%), so dass bei Adipositas-assoziiertem Diabetes und Betazellversagen (inadäquat-erniedrigtem C-Peptid) sowie autosomal-dominantem Erbgang eines Diabetes in den Familien eine MODY-Diagnostik vorgenommen werden sollte.
Bei Kindern mit Trisomie 21 kann ein sehr früher, antikörpernegativer Typ-1 Diabetes auftreten.
Synonyme
- Diabetes mellitus Typ 3
- familiärer Diabetes mellitus
- Diabetessyndrome
- nicht immuner Diabetes
- Diabetes mellitus Typ 1B
Keywords
- Monogenetischer Diabetes
- Neonataler Diabetes
- MODY
- DEND
Definition
- angeborene Diabetesformen: junge Patienten mit früher Betazelldysfunktion und Diabetesmanifestation, fehlender Autoimmunität gegen Betazellen und ohne ausgeprägte Insulinresistenz, einem typischen Aspekt des Diabetes mellitus Typ 2
- neonataler Diabetes mellitus (NDM): Manifestation zumeist innerhalb von 26 Wochen nach Geburtstermin, sehr wahrscheinlich monogenetisch bedingt, kann transient verlaufen oder lebenslang persistieren. Transiente Formen haben ein hohes Rückfallrisiko ab dem Pubertätsalter.
- MODY: familiäre Diabetesform ohne Zeichen einer Autoimmunität; dominantes Vererbungsmuster, Manifestation beginnend ab Pubertätsalter; erhaltene Insulinrestsekretion, Manifestation ohne Ketoazidose
- syndromale Diabetesformen: mitochondrialer Diabetes, Insulinresistenzsyndrome oder weitere assoziierte Fehlbildungen
Epidemiologie
Häufigkeit
- Angeborene Diabetesformen sind seltene Erkrankungen.
- Anhand der DPV-Datenbank wurden 2010 0,17% aller pädiatrisch registrierten Diabetesfälle mit einem Beginn bis zur 26. Lebenswoche einem neonatalen Diabetes zugeordnet. Dies entsprach einer Inzidenz von mindestens 1/89000 Lebendgeburten in Deutschland und Österreich.
- Am häufigsten finden sich KCNJ11-Mutationen, gefolgt von ABCC8-Mutationen, mit zunehmendem Alter nimmt die Häufigkeit von Mutationen im Proinsulingen INS zu.
- In allen Altersgruppen werden monogenetische Diabetesformen mit einer Prävalenz von bis zu 3% vermutet, wobei ein Großteil der Patienten noch als Typ-1- oder Typ-2-Diabetes fehldiagnostiziert sein dürfte und entsprechend behandelt wird.
- Inzidenz bei ca. 1/23.000 liegend (United Team Studie)
- Bislang werden mindestens 13 MODY-Formen entsprechend des zugrunde liegenden Gendefekts definiert.
- Die häufigsten MODY-Typen sind der GCK-MODY (MODY2), HNF1A-MODY (MODY3) und HNF4A-MODY (MODY1). Diese Formen sind autosomal-dominant vererbt.
- Während bei Erwachsenen am häufigsten der HNF1A-MODY (53%) vor dem GCK-MODY (41%) und HNF4A-MODY (5%) diagnostiziert wurde, war bei Patienten <18 Jahren die Diagnose MODY2 mit >40% am häufigsten gestellt worden.
Altersgipfel
-
Der NDM tritt bereits pränatal durch intrauterine Wachstumsverzögerung oder unmittelbar nach Geburt auf. Seltener wird dieser sogenannte neonatale Diabetes mellitus erst mit 2–6 (9) Monaten manifest.
-
MODY manifestiert sich am häufigsten bei Eintreten der Pubertät.
Geschlechtsverteilung
-
NDM 1:1
-
MODY <18 Jahre w:m 60/40, >18 Jahre ca. 1:1.
Prädisponierende Faktoren
-
Elternteil mit Diabetes mellitus
-
Konsanguinität (permanenter, neonataler Diabetes)
-
erhöhte Insulinresistenz
Ätiologie und Pathogenese
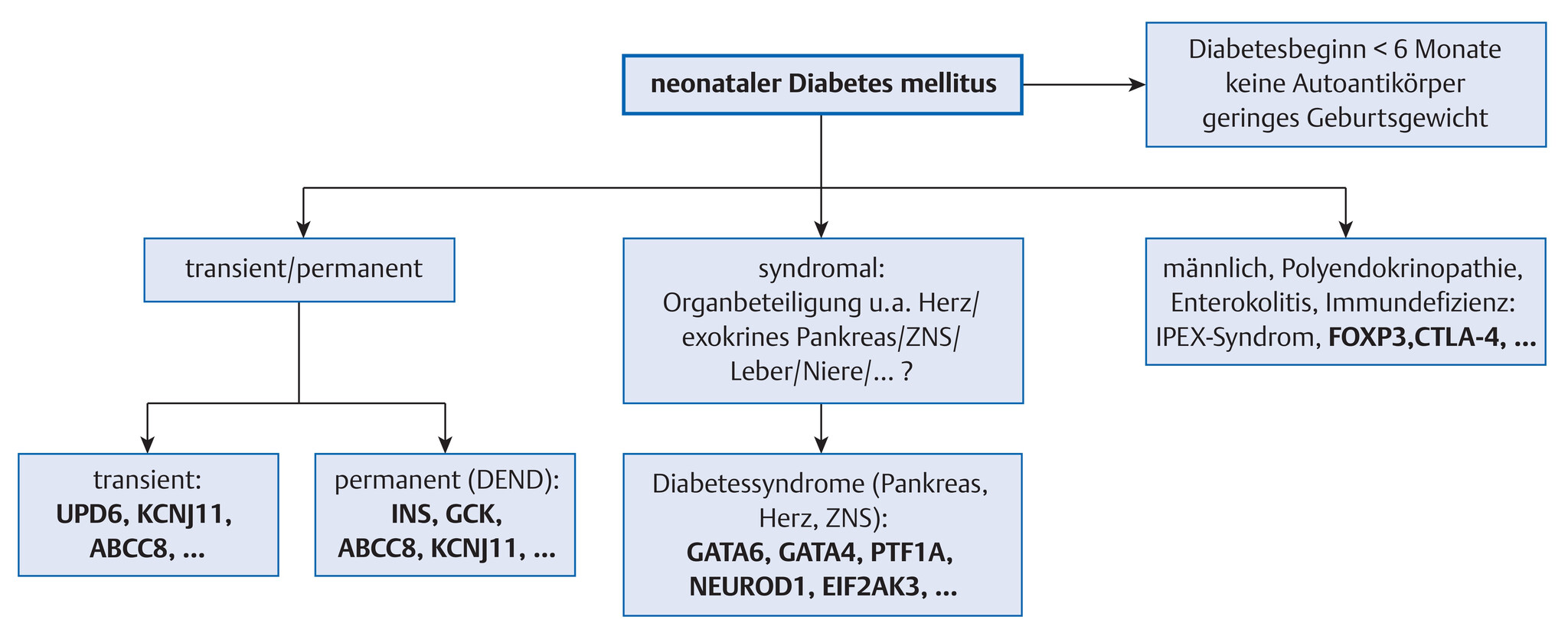
- Entsprechend des spezifischen, genetischen Defekts kann die gestörte Insulinsekretion verursacht werden durch (Abb. 10.17)
- eine gestörte ATP-Bildung (GCK-MODY, mitochondrialer Diabetes),
- eine gestörte Kanalfunktion des ATP-abhängigen Kaliumkanals (K-ATP-Kanäle = Sulfonylharnstoffrezeptoren; Gene ABCC8, KCNJ11),
- eine gestörte Insulintranskription (HNF1A, HNF4A, INS, PDX1) oder
- eine Anlagestörung von Pankreas und Inseln (u.a. HNF1B, PTF1A, NEUROD1).
- Hyperglykämie und Diabetes können dabei allein oder in Kombination mit anderen Organdefekten auftreten.
- Die Schwere der Insulinsekretionsstörung bedingt die Schwere der Erkrankung als permanenter neonataler Diabetes mellitus (PNDM), transienter neonataler Diabetes mellitus (TNDM) oder MODY.
- Bei bis zu 40% der PNDM-Formen lassen sich bisher keine Mutationen zuordnen.
Abb. 10.17 Symptomorientierte, genetische Stufendiagnostik bei neonatalem Diabetes mellitus. DEND: Developmental Delay, Epilepsy and Neonatal Diabetes mellitus. Initiale Prüfung, ob nicht primär Next Generation Sequencing (NGS)/Paneldiagnostik zielführender und kosteneffizienter ist.
Symptomatik
Neonataler Diabetes mellitus
- intrauteriner Insulinmangel und Wachstumsverzögerung mit bis zu 40% reduziertem Geburtsgewicht
- postnatale Gedeihstörung
- Hyperglykämie und Glukosurie, sehr selten Ketoazidose
MODY
- variables Geburtsgewicht: mütterlicher Überträger höheres, väterlicher Überträger niedrigeres Geburtsgewicht
- fehlendes Übergewicht
- häufig asymptomatisch (keine Polyurie und Polydipsie)
- Glukosurie oder sporadische Hyperglykämie (HbA1c-Erhöhung)
- indirekte Symptome: Sehstörungen, Müdigkeit, Leistungsknick
- Ketoazidose selten, bei einzelnen MODY-Typen im Verlauf möglich
Diagnostik
Diagnostisches Vorgehen
- insgesamt hohe Variabilität bei den Betroffenen hinsichtlich des Alters bei Diagnosestellung, der Ausprägung der Hyperglykämie, der benötigten Therapie wie Insulin oder der Entwicklung von Folgeerkrankungen
- bei neonatalem Diabetes ohne Hinweis auf andere Organanomalien, negativen Autoantikörpern und fehlender exokrine Pankreasinsuffizienz hat die molekulargenetische Panelanalysen mittlerweile die Sequenzierung einzelner Kandidatengene abgelöst:
- Anomalien des Chromosoms 6q24 (TNDM)
- Mutationen des KCNJ11-Gens (PNDM, TNDM)
- Mutationen des ABCC8-Gens (PNDM, TNDM)
- Mutationen des Insulingens (PNDM)
- bei verminderter Elastase im Stuhl und negativer molekulargenetischer Analyse bezüglich Chromosom 6q24, KCNJ11-, ABCC8- und INS-Gen sowie negativen oder positiven Autoantikörpern: Untersuchung auf seltenere genetische Erkrankung/genetisches Syndrom (z.B. Pankreasaplasie)
- Abb. 10.17 zeigt das diagnostische Vorgehen bei Diabetesmanifestation bis zum 6. Lebensmonat, gegebenenfalls bis zum 1. Lebensjahr.
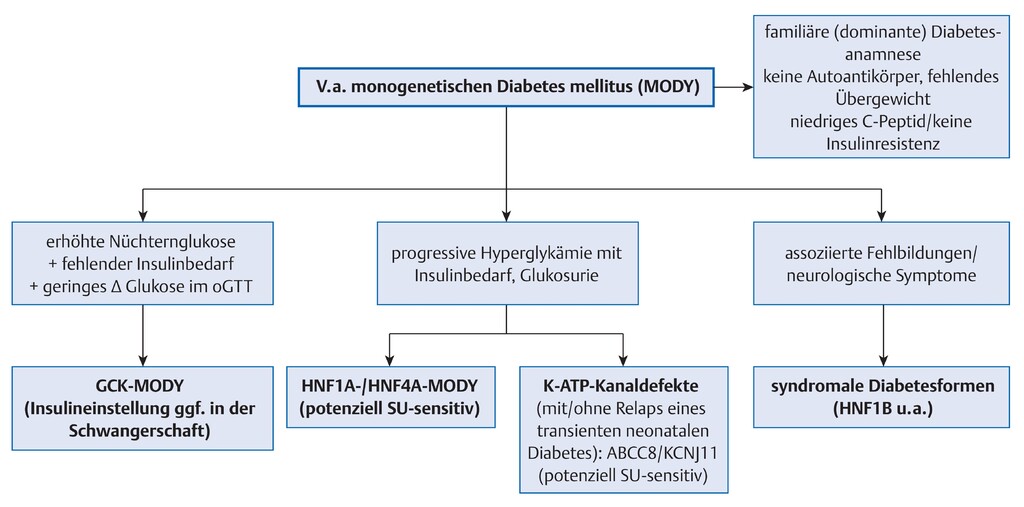
- In Abb. 10.18 ist das diagnostisches Vorgehen bei Manifestation im Jugendalter abgebildet.
- Bei klinischem Verdacht auf MODY kann zunächst zwischen den häufigsten Formen (GCK- und HNF1A-MODY) unterschieden werden.
- GCK-MODY hat typischerweise einen schwachen Anstieg im oralen Glukosetoleranztest, während der HNF1A-MODY im oralen Glukosetoleranztest eine ausgeprägte Insulinsekretionsstörung mit deutlichem Blutzuckeranstieg zumeist über 60 mg/dl (3,5mmol/l) zeigt.
- K-ATP-Kanaldefekte und sehr seltene, rezessive Formen oder Diabetessyndrome müssen aufgrund des spezifischen Symptommusters molekulargenetisch untersucht werden.
Abb. 10.18 Symptomorientierte, genetische Stufendiagnostik bei Manifestation des monogenetischen Diabetes mellitus im Kindesalter/in der Adoleszenz. Sehr seltene, syndromale Diabetesformen sind nicht weiter differenziert.
Anamnese
- neonatale Manifestation: geringes Geburtsgewicht durch intrauterine Wachstumsretardierung, fehlende Gewichtszunahme trotz ausreichendem Trinken, später dann Gewichtsabnahme, reduziertes Trinken und generalisierte muskuläre Hypotonie, Dehydratation und Somnolenz
- MODY: häufig ein Elternteil mit Antikörper-negativem Diabetes, fehlende Symptome oder langsamer Symptombeginn, Polyurie und Polydipsie, sehr selten Ketoazidose
Körperliche Untersuchung
- allgemeine körperliche Untersuchung
- Hinweise auf syndromale Zeichen
- Hautbefund (Akantosis)
- Körperfettverteilung
- Wachstums- und Gewichtsentwicklung
Labor
- BGA, Glukose, Laktat, Keton (Betahydroxybutyrat), Betazellautoantikörper (GAD, IA-2, ZnT8, IAA/ICA), HbA1c
- bei latentem Verlauf oGTT mit Insulin-/C-Peptid-Bestimmungen zur Beurteilung der Insulinsekretionskapazität
- Leber und Nierenfunktion, Lipase, ggf. Elastase im Stuhl (exokrine Pankreasfunktion) und nach Klinik Immundiagnostik bzw. Suche nach weiteren Endokrinopathien
- hochsensitives CRP niedriger bei HNF1A-Mody als bei HNF4A oder Diabetes Typ 2
- 2-Stunden postprandiales C-Peptid/Krea im Urin zur Differenzierung zwischen HNF1A und HNF4A vom Diabetes Typ 1 möglich (≥0,2 nmol/ mmol)
Bildgebende Diagnostik
Sonografie
- neonataler Diabetes: Suche nach assoziierten Organfehlbildungen: Pankreas, Nieren (Anlage, Zysten), Leber (Zysten, Gallangangsanlage), ZNS
MRT
-
bei zusätzlichen, neurologischen Symptomen: Kleinhirnhypoplasie/-aplasie bei PTF1A-Mutationen
Histologie, Zytologie und klinische Pathologie
Molekulargenetische Diagnostik
- Voraussetzungen für molekulargenetische Diagnostik (DDG):
- Diabetesmanifestation <6 Monate oder fehlender Nachweis von Autoantikörpern (GAD, IA-2, ZnT8, IAA/ICA) und
- Diabetes (Typ 1 oder Typ 2) bei mind. 3 Generationen in der Familie oder geringer Insulinbedarf nach zwei Jahren Diabetesdauer von unter 0,5 IE/kg KG/d oder Diabetes ohne Übergewicht
- genetische Testung auf monogene Diabetesformen, vorrangig als Massensequenzierung (Next Generation Sequencing: Targeted Enrichment/Whole Exome). Eine Einzelgensequenzierung ist lediglich bei Familienuntersuchungen zu einer bekannten Mutation indiziert.
Differenzialdiagnosen
- s. Tab. 10.24.
|
MODY
|
|
|
idiopathischer, Typ-1B-Diabetes |
geringer Teil der autoimmun vermittelten Diabetesfälle bleibt Autoantikörper-negativ, Verlauf wie Typ-1-Diabetes (Remissionsphase) |
|
Typ-2-Diabetes |
MODY zeigt in der Regel einen Insulinsekretionsdefekt, während Typ-2-Diabetes in der Anfangsphase durch Hyperinsulinismus (hohes C-Peptid, hohen HOMA-IR, Akanthosis nigricans) charakterisiert ist. Bei erhöhtem BMI ist die klinische Abgrenzung MODY/T2DM erschwert. |
|
erniedrigter BMI, fehlendes subkutanes Fettgewebe (partiell oder generalisiert), C-Peptid und HOMA massiv erhöht, teils ausgeprägte Akanthosis und Gewebsfibrose Extremformen: Leprechaunismus und Rabson-Mendenhall-Syndrom (Insulinrezeptor-Mutationen) |
|
|
neonataler Diabetes
|
|
|
maternale Faktoren: Plazentastörungen, Nikotin, Drogen und Alkohol, Präeklampsie, Hypertonie kindliche Faktoren: Chromosomenstörungen, Infektionen, Syndrome (Trisomie 21, Silver-Russell-Syndrom) |
|
|
transiente Hyperglykämie |
u.a. schwere Krankheit (Sepsis), schwere Dehydratation (Stresshyperglykämie), medikamenteninduziert (Steroide, Katecholamine) |
Therapie
Therapeutisches Vorgehen
Neonataler Diabetes
- Langzeitergebnisse zu oraler Therapie bei Kaliumkanaldefekten (ABCC8- und KCNJ11-Mutationen) mit hoch dosiertem Sulfonylharnstoff (Glibenclamid) zeigen mittlerweile relative Sicherheit und fehlende, schwere Hypoglykämien.
- Bei zusätzlich auftretendem DEND (Developmental Delay, Epilepsy and Neonatal Diabetes mellitusDevelopmental Delay, Epilepsy and Neonatal Diabetes mellitus) kann GlibenclamidGlibenclamid präventive oder teilweise kurative Effekte auf die assoziierten, neurologischen Symptome haben.
- Ein Großteil der Patienten benötigt keine Insulintherapie.
- Chromosom-6-assoziierter, neonataler Diabetes verläuft transient und kann ebenfalls auf Sulfonylharnstoffe ansprechen.
- Bei fehlender Sulfonylharnstoff-Sensibilität ist eine sensorgesteuerte Insulinpumpentherapie an einem spezialisierten Zentrum empfehlenswert. Abstillen ist nicht indiziert.
MODY
- Abhängig von der molekularen Diagnose bestehen differenzierte Therapieempfehlungen.
- GCK-MODY: Die relativ milde Fastenhyperglykämie verläuft nicht progressiv und lässt sich nur ungenügend mit Insulintherapie oder oraler Therapie einstellen. In der Regel ist keine spezifische Therapie indiziert (Ausnahme: während der Schwangerschaft betroffener Frauen). Kein jährliches Retinopathiescreening erforderlich, da keine mirkro- oder makroangiopathischen Komplikationen zu erwarten.
- HNF1A- und HNF4A-MODY: Orale Therapie mit Sulfonylharnstoffen oder Gliniden sollte versucht werden, ein Großteil der jüngeren Patienten lässt sich nebenwirkungsarm einstellen (komplett oder als basalunterstützte orale Therapie). Die Umstellung von Insulin auf orale Antidiabetika sollte unter enger diabetologischer Überwachung erfolgen.
- HNF1B-MODY: progressiver Verlust der Insulinsekretion, daher bei HbA1c>8% primäre Einstellung auf Insulin; bei Diagnosestellung Suche nach assoziierten Fehlbildungen und Funktionseinschränkungen an Nieren, Leber und Geschlechtsorganen
- Ergebnisse einer molekulargenetischen Testung sollte Familien klar und unmissverständlich erklärt werden, insbesondere, weil die Diagnosestellung therapeutische und prognostische Konsequenzen mit sich bringt. Wünschenswert ist daher die Beratung durch spezialisierte Humangenetiker oder Endokrinologen/Diabetologen.
Pharmakotherapie
- Neonataler Diabetes aufgrund von ABCC8-/KCNJ11-Mutationen, evtl. auch transienter neonataler Diabetes bei UPD6, kann mit Sulfonylharnstoffen langfristig stabil eingestellt werden.
- Die häufigsten MODY-Typen (GCK- und HNF1A-Mutationen) können oft mit reiner Lifestyle-Intervention (GCK) oder oraler Therapie (HNF1A, Sulfonylharnstoffe und Glinide) erfolgreich eingestellt werden.
- Insulintherapie bei fehlendem Ansprechen auf orale Antidiabetika
- GLP-1-Rezeptor Agonisten als mögliche Therapieoption bei Therapieversagen (nicht zugelassen!)
| Merke Patienten mit akutem Koronarsyndrom und langjährigem Diabetes mellitus Typ 2 können aufgrund einer diabetischen Neuropathie ein atypisches bis asymptomatisches Beschwerdebild bieten, sodass hier niedrigschwellig an eine kardiale Diagnostik gedacht werden sollte. |
| Merke Ein Diabetes mellitus in Kombination mit Schwerhörigkeit oder Taubheit kann Hinweis auf die seltene Form eines mitochondrial bedingten Diabetes mellitus geben. |
Nachsorge
-
Kinder mit transientem, neonatalem Diabetes sollten aufgrund des Rückfallrisikos bis zum Abschluss der Pubertät ein regelmäßiges Diabetescreening erhalten (jährlich, HbA1c). Eine Aufklärung bez. erhöhtem Risiko eines Gestationsdiabetes sollte mit jugendlichen Mädchen erfolgen.
Verlauf und Prognose
-
Eine bessere Aussage zu Verlauf und Prognose ist mit molekulargenetischer Diagnose möglich.
-
Diabetesbedingte Prognose und Lebenserwartung hängen – wie bei Typ-1-Diabetes – von der langfristig erreichten Stoffwechseleinstellung und weiteren möglicherweise bestehenden assoziierten Fehlbildungen ab.
Literatur
Quellenangaben
-
[1] Bowman P, Mathews F, Barbetti F, et al. Long-term Follow-up of Glycemic and Neurological Outcomes in an International Series of Patients With Sulfonylurea-Treated ABCC8 Permanent Neonatal Diabetes. Diabetes Care. 2021;44(1):35-42
Suche in: PubMed Google Scholar -
[2] Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015;17(5):405-424
Suche in: PubMed Google Scholar