Diabetes mellitus Typ 2
Endokrinologie und Diabetologie
Steckbrief
Der Diabetes mellitus Typ 2 ist eine Stoffwechselerkrankung, die mit Bewegungsmangel, falscher Ernährung und Adipositas einhergeht. Die Prävalenz ist in der westlichen Welt und insbesondere in den Schwellenländern stetig steigend. Pathophysiologisch liegen eine gestörte Insulinsekretion sowie eine Resistenz gegenüber der Wirkung von Insulin zugrunde. Die Therapieoptionen sind vielfältig, jedoch ist der Langzeiterfolg eingeschränkt. Mit Zunahme der Krankheitsdauer können folgenschwere kardiovaskuläre Erkrankungen auftreten (z.B. Bluthochdruck, Herzinfarkt, Schlaganfall). Eine Risikoreduktion ist schwierig, da gelernte Verhaltensweisen nur schwer rückgängig zu machen sind.
Aktuelles
- Neue inkretinbasierte Medikamente (GLP-1-Analoga) sowie auch Glukosuria (SGLT2-Inhibitoren) senken kardiovaskuläre Ereignisse und die Sterberate bei Patienten mit Diabetes mellitus Typ 2 und einem hohen kardiovaskulären Risiko.
- GLP-1-Analoga wie Liraglutid und Semaglutid sind als neue Medikamente zur adjuvanten Therapie der Adipositas zugelassen.
Synonyme
- Diabetes
- Zuckerkrankheit
Keywords
- Diabetes mellitus Typ 2
- Diabetes
- Zuckerkrankheit
Definition
- Diabetes mellitus Typ 2 ist eine chronische Glukosestoffwechselstörung, die mit erhöhten Blutzuckerwerten (Hyperglykämie) einhergeht.
- Dem Diabetes liegt eine Insulinresistenz und/oder eine gestörte Insulinsekretion zugrunde.
- Mit längerer Krankheitsdauer kann es zu schwerwiegenden Erkrankungen des arteriellen Gefäßsystems sowie zu mikrovaskulären Schäden der Nieren, der Nerven und der Augen kommen.
Epidemiologie
Häufigkeit
- Die Prävalenz des Diabetes mellitus Typ 2 liegt in Deutschland bei 7,4% (Stand 2016).
- Zwischen 1980 und 2014 hat sich die Zahl der über 18-Jährigen mit Diabetes mellitus Typ 2 fast vervierfacht.
- Weltweit leiden ca. 422 Mio. Menschen an Diabetes.
Altersgipfel
-
Mit zunehmendem Alter steigt der Anteil der Diabetiker. So sind z.B. im Alter von 70–79 Jahren ca. 22 % der Männer und Frauen an diabetes mellitus Typ 2 erkrankt.
Geschlechtsverteilung
-
Die Prävalenz ist bei Männern mit 8,4% höher als bei Frauen mit 6,4%.
Prädisponierende Faktoren
- Bewegungsmangel, Fehlernährung und Adipositas
- familiäre Vorbelastung
- Endokrinopathien, z.B. Cushing-Syndrom oder Akromegalie
- Pankreaserkrankungen, z.B. chronische Pankreatitis oder Hämochromatose
- andere prädisponierende Faktoren: Fettstoffwechselstörungen, Fettleber (Steatosis hepatis), medikamentöse Therapien (z.B. Glukokortikoide) und syndromale Erkrankungen wie das Down-Syndrom (Trisomie 21) oder das Turner-Syndrom (45,X0)
Ätiologie und Pathogenese
- Durch chronische Fehlernährung, mangelnde körperliche Betätigung und Adipositas kommt es zu einer zunehmenden Insulinresistenz, die u.a. durch chronisch erhöhte inflammatorische Zytokine insbesondere aus dem viszeralen Fettgewebe gefördert wird.
- Insulinresistenz führt zur gesteigerten Insulinsekretion, was den ersten Schritt hin zu einem gestörten glukotropen Regelkreis darstellt.
- Dies führt zu einem relativen Insulinmangel und grenzt somit den Diabetes mellitus Typ 2 vom Typ 1 ab, der durch einen absoluten Insulinmangel charakterisiert ist.
- Eine Zunahme der Insulinresistenz und metabolischer Stress auf die insulinproduzierenden Betazellen des Pankreas führen zu einer gestörten Glukoseregulation, die gekennzeichnet ist durch
- eine verminderte insulinvermittelte Aufnahme von Glukose in periphere Gewebe (insbesondere Skelettmuskel) sowie
- eine vermehrte Glukoseproduktion durch die Leber (hepatische Glukoneogenese).
- Die daraus resultierende Hyperglykämie führt zu einer nicht enzymatischen Glykierung von Plasmaproteinen, deren Inaktivierung und Ablagerung sowie Schädigung der Gefäßwand.
- Lokale Ausschüttung von Wachstumsfaktoren kann zu Gefäßneubildungen führen (diabetische Retinopathie).
- Komplikationen durch fortgeschrittene mikro- und makrovaskuläre Veränderungen können zu einem verfrühten Tod führen.
- Glukosespiegel über 600–1000mg/dl überschreiten die Nierenschwelle (ab ca. 180mg/dl) und führen zur charakteristischen Glukosurie, die mit einer Polyurie und einer progredienten Dehydratation einhergeht.
- Elektrolytentgleisungen, Bewusstseinseintrübungen, Volumenmangelschock, Nierenversagen und ein hyperosmolares Koma können die Folge sein.
- In der hyperglykämen Entgleisung verhindert die Hyperinsulinämie eine ketoazidotische Entgleisung durch Hemmung der Lipolyse im Fettgewebe (Unterschied zu Typ-1-Diabetes).
Symptomatik
- Meist handelt es sich um eine schleichende Symptomatik über mehrere Jahre, sodass die Diagnose häufig ein Zufallsbefund ist.
- Häufig sind bereits diabetesassoziierte Komplikationen (z.B. Herzinfarkt, Sehminderung oder diabetisches Fußsyndrom etc.) vorhanden.
- Polyurie, Polydipsie und Gewichtsverlust gehören zur typischen vegetativen Anamnese.
- Diese Symptome sind jedoch nicht so stark ausgeprägt wie beim Diabetes mellitus Typ 1.
- Weitere Symptome sind Leistungsminderung, Libido- und Potenzverlust, Inappetenz, Infektanfälligkeit, Pruritus, Sehstörungen sowie Heißhungerattacken bei reaktiven Hypoglykämien (durch Insulinresistenz und damit einhergehende Hyperinsulinämie hervorgerufen).
- Bei seltenen schweren Verlaufsformen kann eine Erstmanifestation auch im Rahmen eines hyperosmolaren Komas auftreten.
- akute Komplikationen: Die akute Hyperglykämie kann neben der o.g. Symptomatik auch mit Übelkeit, Erbrechen, Bauchschmerzen, akutem Abdomen (Pseudoperitonitis diabetica), Verwirrtheit, Somnolenz und Koma einhergehen.
- Das hyperosmolare Koma tritt meist bei sehr hohen Blutzuckerwerten auf (teilweise >1000mg/dl) und geht mit einer schweren Dehydratation und einer Elektrolytverschiebung einher.
- Eine pH-Verschiebung wie bei der Ketoazidose tritt üblicherweise nicht auf.
- Eine Hypoglykämie kann reaktiv ca. 2–5h nach Nahrungsaufnahme auftreten oder im Rahmen einer insulinotropen Therapie (z.B. Sulfonylharnstoffe oder Insulintherapie).
- Bei häufigen Hypoglykämien kommt es zu einer Verschiebung der Wahrnehmungsgrenze nach unten und auch die physiologische Gegenregulation durch Glukagon oder Kortisol kann gestört werden (z.B. durch häufiges nächtliches Unterzuckern).
- chronische Komplikationen: Mit fortschreitender Erkrankung kommt es vermehrt zu makrovaskulären Erkrankungen, die zu Herzinfarkt, Schlaganfällen sowie peripherer arterieller Verschlusskrankheit (pAVK) führen.
- Mikrovaskuläre Komplikationen betreffen zumeist Nieren, Augen und Nerven und sind stark mit der Blutzuckereinstellung vergesellschaftet.
- Die diabetische Retinopathie als mikrovaskuläre Komplikation wird eingeteilt in die nicht proliferative und die proliferative Retinopathie.
- Die nicht proliferative Retinopathie geht mit Mirkroaneurysmen, Cotton-Wool-Exsudaten, perlschnurartigen Venenveränderungen und intrarenalen Blutungen einher, während die proliferative Retinopathie durch Gefäßproliferationen charakterisiert ist, was zu Glaskörpereinblutungen, Netzhautablösungen mit starkem Visusverlust bis hin zur Erblindung führen kann.
- Zudem kommt die diabetische Makulopathie mit Makulaödem häufig vor.
- Die diabetische Nephropathie (Glomerulosklerose oder Kimmelstiel-Wilson-Syndrom) geht mit einer Schädigung der glomerulären Kapillaren einher.
- Dadurch kommt es zu einer erhöhten Permeabilität für Eiweiße, was das Fortschreiten hin zur Glomerulosklerose und schlussendlich terminalen Niereninsuffizienz fördert.
- Ca. ein Drittel aller Dialysepatienten leidet an den Folgen einer diabetischen Nephropathie.
- Die diabetische Polyneuropathie betrifft das sensomotorische und autonome Nervensystem und ist abhängig von Alter, Erkrankungsdauer sowie der Blutzuckereinstellung.
- Die periphere symmetrische Form ist häufig, vorwiegend sensibel und in ca. 10% der Fälle schmerzhaft.
- Zudem gibt es die proximale asymmetrische Form (primär Beckengürtel und Oberschenkel), die Hirnnervenneuropathie sowie die autonome Neuropathie (parasympathische und sympathische Nerven). Eine Gastroparese und Herzrhythmusstörungen können Folge der autonomen Neuropathie sein.
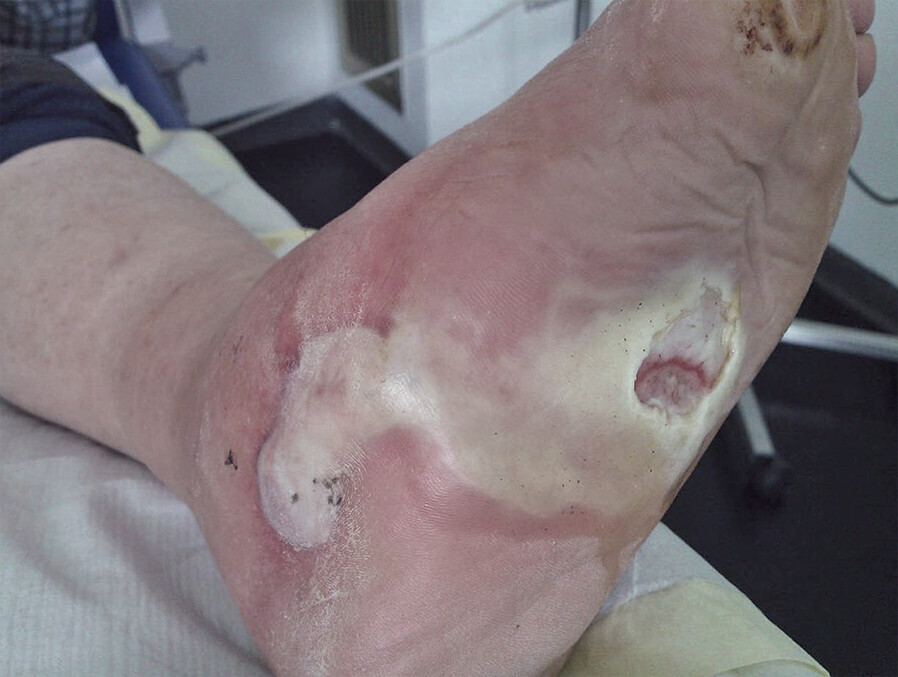
- Eine Sonderform der chronischen Komplikationen ist das diabetische Fußsyndrom . Hierbei wird zwischen einem neuropathischen und einem ischämischen Fußsyndrom unterschieden.
- Haupursachen sind eine Neuropathie sowie eine pAVK. Ein häufiger begünstigender Faktor ist das Fehlen einer diabetischen Fußpflege sowie das Tragen von falschem Schuhwerk.
- Hautläsionen betreffen beim neuropathischen Fußsyndrom primär Druckbelastungsstellen (Ulzera) (Abb. 10.4).
- Beim ischämischen Fußsyndrom sind primär die Akren als Endstromgebiet der arteriellen Gefäße betroffen und durch eine Nekrose gekennzeichnet.
- Der Schweregrad des diabetischen Fußsyndroms wird kombiniert nach der Wagner-Klassifikation und den Armstrong-Stadien eingeteilt.
| Merke Patienten mit einer insulinotropen Therapie sollten immer über die Symptomatik einer Hypoglykämie und das Mitführen von Traubenzucker geschult werden. Bei komatösen Patienten sollte differenzialdiagnostisch immer an eine Hypoglykämie gedacht werden. |
| Merke Patienten mit akutem Koronarsyndrom und langjährigem Diabetes mellitus Typ 2 können aufgrund einer diabetischen Neuropathie ein atypisches bis asymptomatisches Beschwerdebild bieten, sodass hier niedrigschwellig an eine kardiale Diagnostik gedacht werden sollte. |
Abb. 10.4 Neuropathische Variante des diabetischen Fußsyndroms.
Diagnostik
Diagnostisches Vorgehen
- Im Vordergrund der Diagnostik des Diabetes mellitus Typ 2 steht die individuelle Risikobewertung durch den Arzt.
- Eine gezielte vegetative Anamnese, Allgemeinanamnese sowie Anamnese der Begleiterkrankungen gibt wichtige Hinweise für ein erhöhtes Diabetesrisiko.
- Die körperliche Untersuchung ergänzt dieses Bild und sollte stets die gezielte Untersuchung von sekundären Komplikationen miteinbeziehen.
- Die finale Diagnose wird über die Bestimmung der Plasmaglukose bzw. des HbA1c gestellt.
- In einem oralen Glukosetoleranztest können zudem die Insulinresistenz sowie eine gestörte Glukosetoleranz als „Vorstufen“ des Diabetes mellitus Typ 2 erkannt werden.
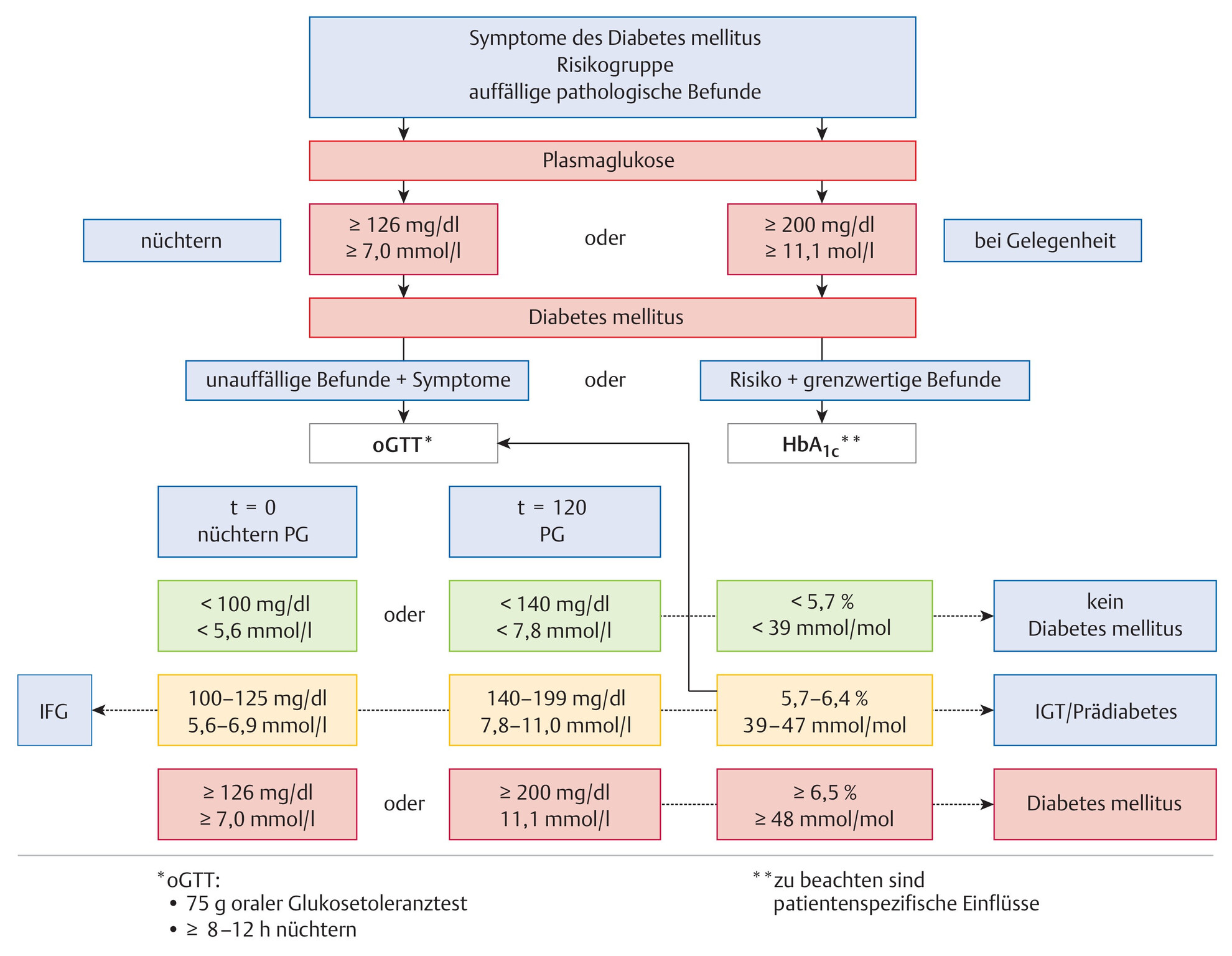
- Ein diagnostischer Algorithmus ist in Abb. 10.5 gegeben.
Abb. 10.5 Diagnostischer Algorithmus bei Verdacht auf Diabetes mellitus Typ 2.
(Quelle: Schleicher E, Dörner K. Laborparameter zur Bestimmung der Glykämie. In: Kohse K, Hrsg. Taschenlehrbuch Klinische Chemie und Hämatologie. 9. Aufl. Stuttgart: Thieme; 2019)
Anamnese
- Die Anfangsstadien der diabetischen Retinopathie, Nephropathie und Neuropathie werden meist nicht wahrgenommen.
- vegetative Anamnese: Polyurie, Polydipsie, Gewichtsverlust, Libido- und Potenzverlust, Infektanfälligkeit (insbesondere Urogenitalinfekte), Visusverlust
- Eigenanamnese: auf Anzeichen des metabolischen Syndroms achten (Diabetes mellitus Typ 2 oder gestörter Glukosemetabolismus, viszerale Adipositas, Fettstoffwechselstörung, arterielle Hypertonie)
- Familienanamnese: Diabetes mellitus Typ 2 tritt gehäuft familiär auf.
Körperliche Untersuchung
- Body-Mass-Index (BMI) dokumentieren (Körpergewicht [kg]/Körpergröße [m2])
- Patienten mit einem BMI 25–29,9 sind übergewichtig, ein BMI ≥30 gilt als adipös.
- Untersuchung der Thorax- und Bauchorgane (Herzklappen, Lunge, Leber, Nieren, Milz, Aorta) inklusive Herzfrequenz, Rhythmus und Blutdruckmessung
- beachte: Zeichen eines Hyperkortisolismus (Striae rubrae, Virilisierung, prox. Muskelschwäche, Plethora, vergrößertes nuchales Fettpolster, Atrophie des Unterhautfettgewebes der Extremitäten, Pergamenthaut etc.)
- initial und fortan einmal pro Jahr Erhebung der Tiefensensibilität mittels Stimmgabel
- Klassische Untersuchungspunkte sind Malleolus medialis und Großzehengrundgelenk.
- Die Schweregradeinteilung erfolgt in Achtel, wobei 8/8 eine voll erhaltene und 0/8 eine nicht mehr vorhandene Tiefensensibilität bedeutet.
- wichtig: Inspektion der Haut, insbesondere untere Extremität, Fußsohle, Zehenzwischenräume (Ulzera), sowie Gefäßstatus (pAVK)
Labor
- Die Diagnose erfolgt über die Bestimmung der Plasmaglukose durch qualitätsgeprüfte Labormethoden. Die Normwerte variieren je nach gewonnenem Material (Vollblut, Plasma, venös, kapillär).
- Neben der Blutglukose kann auch der HbA1c bestimmt werden. Dieser gilt auch als hervorragender Verlaufsparameter, da er die Glukoseregulation der letzten 8–10 Wochen wiedergibt. Die Norm- und Grenzwerte zur Diagnosestellung des Diabetes mellitus Typ 2 sind in Abb. 10.5 dargestellt.
- Die Goldstandard-Methode ist der orale Glukosetoleranztest (oGTT).
- Voraussetzungen: 3 Tage zuvor die Ernährungsgewohnheiten nicht ändern oder eine kohlenhydratreiche Ernährung (mindestens 150g Kohlenhydrate) einhalten und am Testtag ca. 10–12h nüchtern sein
- Durchführung: 75g Glukose gelöst in 250–300ml Wasser oral verabreichen, venöse Blutentnahmen zum Zeitpunkt 0 und 120min (weitere Messzeitpunkte für wissenschaftliche Fragestellungen möglich, ggf. auch mit Insulinmessung)
- weitere Labordiagnostik: Elektrolyte, Nierenparameter, Blutfette, Leberwerte, Blutbild, ggf. Autoantiköper (GAD-Ak, IA2-Ak, zum Ausschluss eines Diabetes mellitus Typ 1) und C-Peptid
- Abschätzung einer möglichen Nierenschädigung mittels Albuminausscheidung im Urin (unter 20mg/l ist normal, bei über 20mg/l besteht eine Mikro-, über 200mg/l eine Makroalbuminurie als Zeichen der diabetischen Nephropathie)
| Merke Für den oGTT sollte immer ein venöser Zugang gelegt werden, da insbesondere bei adipösen Patienten mit einer massiven Insulinresistenz zu rechnen ist, die unter diesen Testumständen nicht selten zu einer reaktiven symptomatischen Hypoglykämie führen kann. Die Möglichkeit der raschen intravenösen Glukoseapplikation kann hier wichtig werden. |
Mikrobiologie und Virologie
Kulturen
- Insbesondere beim diabetischen Fußsyndrom ist es wichtig, einen Wundabstrich abzunehmen, um ggf. eine gezielte antibiotische Therapie zu ermöglichen.
- Bei fortgeschrittenen systemischen Infektionen ist die Abnahme von Blutkulturen aus gleichen Gründen obligat.
Bildgebende Diagnostik
Sonografie
- Abdomensonografie: Untersuchung der Leber (Hepatomegalie, Steatosis hepatis), der Nieren sowie des Pankreas (Verfettung, Pankreatitis, Tumor)
- Gefäßsonografie: Halsgefäße, Bauchaorta, Iliakalgefäße, ggf. periphere Beinarterien
| Merke Ein plötzlich auftretender Diabetes mellitus Typ 2 mit hohen Blutzuckerspiegeln kann im Rahmen eines paraneoplastischen Syndroms auftreten und Ausdruck eines Pankreaskarzinoms sein. Es sollte in diesen Fällen nicht auf eine Abdomensonografie verzichtet werden, zumal dadurch oft Frühstadien der Tumorerkrankung festgestellt werden. |
Histologie, Zytologie und klinische Pathologie
Molekulargenetische Diagnostik
- Die molekulargenetische Diagnostik ist wichtig zur Differenziealdiagnostik.
- Dazu gehören die Formen des Maturity Onset Diabetes of the Young (MODY), der Latent Autoimmune Diabetes of the Adult (LADA) und seltene mitochondriale Diabetesformen oder Mutationen im Insulin-Gen.
- Eine Indikation zur molekulargenetischen Diagnostik ist nur in Sonderfällen gegeben und sollte durch einen erfahrenen Diabetologen erfolgen.
Differenzialdiagnosen
- s. Tab. 10.6
|
Körperhabitus meist schlank, Auftreten zumeist im Kinder- oder Jugendalter Pathophysiologisch besteht ein absoluter Insulinmangel (Cave: Gefahr der Ketoazidose). Diagnosesicherung via Autoantikörperbestimmung: Inselzell-Ak (ICA), Antikörper gegen Insulin (Insulin-Ak), Dekarboxylase der Betazellen (GAD65-Ak), Thyrosin-Phosphatase (IA-2-Ak), Zinktransporter 8 (ZnkT8-Ak) |
|
|
Maturity Onset Diabetes of the Young (MODY) |
zumeist vor dem 25. Lebensjahr, klinisch ähnlich dem Diabetes mellitus Typ 2 autosomal dominant vererbte Mutationen in Genen, die die Betazellfunktion beeinflussen Folgende Gene sind z.B. betroffen: HNF4A (Hepatocyte Nuclear Factor-4-alpha), GCK (Glukokinase), HNF1A (Hepatocyte Nuclear Factor-1-alpha) |
|
Latent Autoimmune Diabetes of the Adult (LADA) |
Autoantikörper wie beim Diabetes mellitus Typ 1, aber langsam fortschreitend und erst im fortgeschrittenen Erwachsenenalter manifest Nach ADA-Kriterien wird diese Erkrankung zum Diabetes mellitus Typ 1 gezählt. |
|
Diabetes mellitus Typ 3 |
Dazu gehört der pankreoprive Diabetes mellitus, der durch chronische und akute Pankreatitiden oder Pankreasoperationen ausgelöst werden kann (Cave: meist schwere Einstellung der Therapie). hormonelle Störungen durch z.B. Wachstumshormonexzess (Akromegalie) oder Hyperkortisolismus (Morbus Cushing, Cushing-Syndrom, paraneoplastisch) |
|
mitochondrialer Diabetes mellitus |
seltene Form (<1%), verursacht durch maternal vererbte Mutationen der mitochondrialen DNA Diese Erkrankung geht zumeist mit Schwerhörigkeit oder Taubheit einher. |
| Merke Ein Diabetes mellitus in Kombination mit Schwerhörigkeit oder Taubheit kann Hinweis auf die seltene Form eines mitochondrial bedingten Diabetes mellitus geben. |
Therapie
- Allgemeinmaßnahmen im Sinn einer konservativen Basistherapie
- Bei unzureichender Blutzuckereinstellung Beginn einer Pharmakotherapie mit einem oralen Antidiabetikum (Monotherapie), was dann auf eine Zweier- und in manchen Fällen auch Dreierkombinationstherapie ausgeweitet werden kann.
- Im nächsten Schritt erfolgt eine Insulintherapie, häufig zunächst mit einem Basalinsulin, dann ggf. in Kombination mit kurzwirkenden Insulinen eine intensivierte konventionelle Therapie, ggf. Erweiterung um orale Antidiabetika zur Reduktion der Insulindosen.
- Ist eine konservativ-pharmakologische Therapie nicht erfolgreich oder erfolgsversprechend, kann eine metabolische Chirurgie erwogen werden.
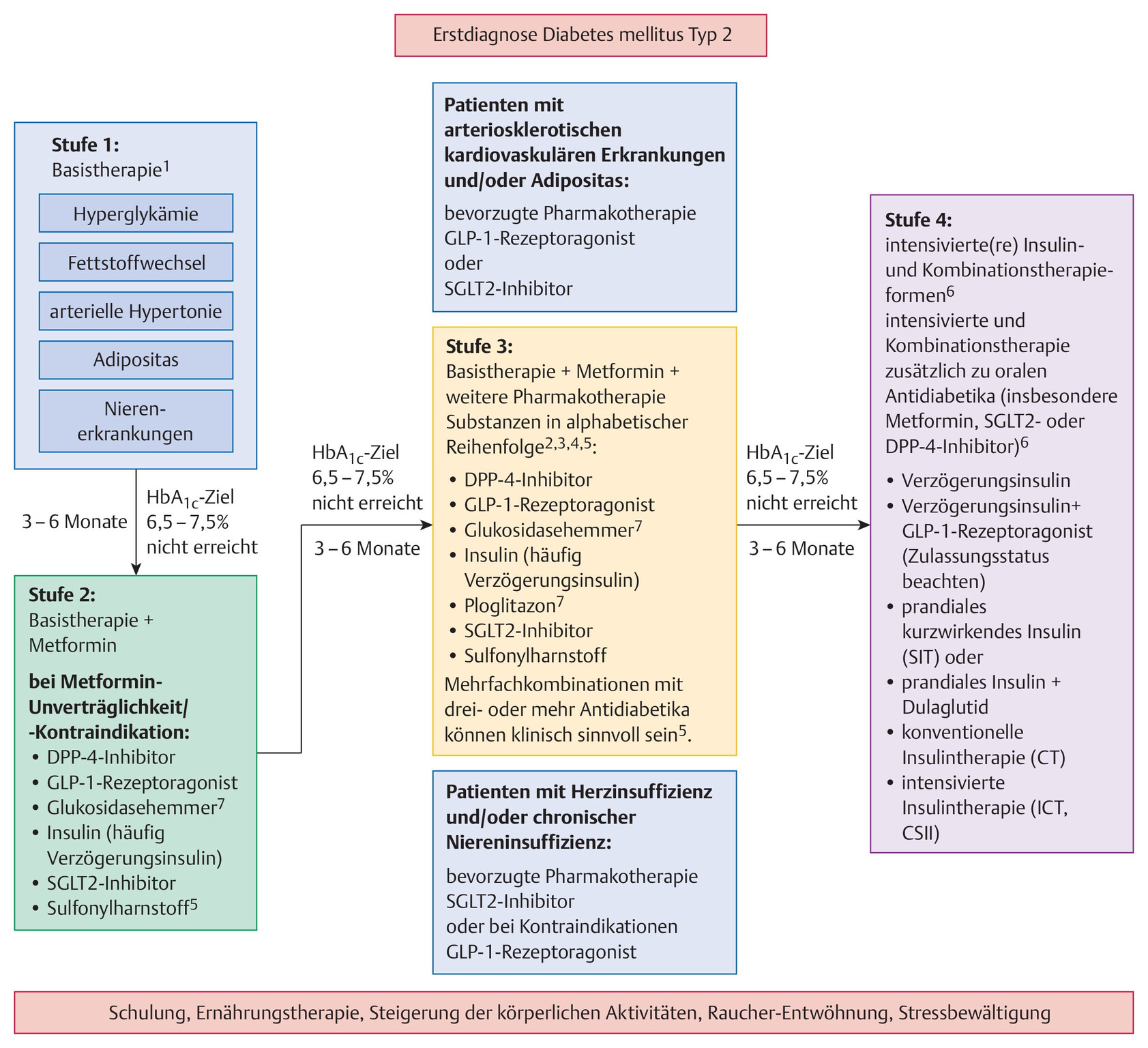
- Eine Übersicht zum medikamentösen Therapiealgorithmus entsprechend den Leitlinien der Deutschen Diabetes Gesellschaft sowie angelehnt an den aktuellen ADA/EASD Konsensus Report [1] ist in Abb. 10.6 dargestellt.
Abb. 10.6 Therapiealgorithmus entsprechend den Leitlinien der Deutschen Diabetes Gesellschaft sowie angelehnt an den aktuellen ADA/EASD Konsensus Report. 1 Lebensstilmodifikation stellt auf jeder Therapiestufe die Basistherapie dar, ist jedoch häufig allein nicht ausreichend. Wenn lebensstilmodifizierenden Maßnahmen keine ausreichenden Erfolge herbeiführen, kann dies sofort mit Metformin kombiniert werden, solange es keine Kontraindikationen gibt. 2 Der therapeutische Stellenwert der einzelnen Wirkstoffe/Wirkstoffgruppen ist den Praxisempfehlungen der Deutschen Diabetes Gesellschaft (DDG) sowie der Nationalen Versorgungsleitlinie (NVL) zu entnehmen. 3 Die Kombination von Metformin und Sulfonylharnstoffen (Glibenclamid) kann möglicherweise die kardiovaskuläre Mortalität erhöhen. Eine Reihe von Metaanalysen umfangreicher retrospektiver Studien zeigt eine signifikante Steigerung kardiovaskulärer Komplikationen und eine erhöhte Mortalität. 4 Bei der Gruppe der Sulfonylharnstoffe ist davon auszugehen, dass nicht alle Wirksubstanzen gleichermaßen nützen. 5 Zu Dreifachkombinationen mit oralen Antidiabetika liegen keine Studien mit klinisch relevanten Endpunkten vor. Das Sicherheitsprofil kann einerseits durch steigende unerwünschte Arzneimittelinteraktionen eingeschränkt sein, andererseits können aber orale Dreifachkombinationen ohne hypoglykämisierende Substanzen Vorteile gegenüber einer Therapieeskalation mit Insulin haben. Die Abnahme der Therapietreue bei Polypharmazie sollte jedoch berücksichtigt werden. Infolge der Erweiterung der Datenlage und mit der Einführung neuer Substanzgruppen ist eine neue Situation entstanden, die Dreifachkombinationen gegenüber der Therapieeskalation in Richtung einer Insulintherapie günstig erscheinen lassen. 6 Bei Nichterreichen des individuellen Therapieziels unter einer ICT stellt die Insulinpumpentherapie eine weitere Therapieoption dar. 7 Diese Substanzen spielen eine geringe Rolle in den Verordnungszahlen. Pioglitazon wird über die GKV nicht mehr erstattet und hat klinisch keine Relevanz mehr [2].
Allgemeine Maßnahmen
- Basistherapie: Umstellung der Ernährungs- und Bewegungsgewohnheiten mittels Kombination aus Ernährungsberatung und Physiotherapie/Sportkursen (multimodal)
- Die Ernährungsberatung sollte nach den Vorgaben der Deutschen Diabetes Gesellschaft individuell angepasst werden. Je nach Motivation und Konstitution des Patienten kann eine Diät mit sehr niedrigem Kaloriengehalt (ca. 800kcal/d) oder eine mäßig kalorienreduzierte Diät (ca. 1500kcal/d) hilfreich sein.
- Eine Gewichtsreduktion ist bei normalgewichtigen oder älteren multimorbiden Patienten nicht zielführend.
- Reduktion von tierischen gesättigten Fettsäuren, stattdessen vermehrt ungesättigte pflanzliche Fette in die Nahrung aufnehmen
- Die Nahrung sollte zu 45–60% aus Kohlenhydraten mit hohem Ballaststoffanteil, 15–20% aus Protein und 25–35% aus Fett bestehen.
- Zur Steigerung der Insulinsensitivität sowie der insulinunabhängigen Glukoseaufnahme in die Skelettmuskulatur ist eine Bewegungstherapie bei Diabetikern besonders wertvoll.
- Therapieziel: dauerhafte Absenkung des HbA1c auf Werte zwischen 6,5 und 7,5%.
- Ein HbA1c-Zielwert <6,5 %soll nur dann angestrebt werden, wenn keine klinisch relevanten Nebenwirkungen auftreten, insbesondere keine Hypoglykämien oder wesentliche Gewichtszunahme (bei zusätzlicher Pharmakotherapie). Bei einem HbA1c <6,5% sollte auf Insulin oder insulinotrope Substanzen verzichtet werden.
- Falls die Basistherapie nicht ausreichend ist, sollte eine orale antidiabetische Therapie zusätzlich begonnen werden (Tab. 10.7).
|
Acarbose, Miglitol, Voglibose |
|
|
Sitagliptin, Vildagliptin, Saxagliptin, Linagliptin, Alogliptin |
|
|
Exenatide, Liraglutid, Dulaglutid |
|
Pharmakotherapie
- Vorgehen:
- Zunächst erfolgt Basistherapie, wenn nicht ausreichend,
- zusätzliche Metformingabe als Therapie der ersten Wahl.
- Wenn nicht ausreichend, sollten Patienten mit arteriosklerotischen kardiovaskulären Erkrankungen und/oder Adipositas zunächst mit einem GLP-1-Analogon (z.B. Liraglutid) oder einem SGLT2-Inhibitor (z.B. Empagliflozin) zusätzlich therapiert werden.
- Patienten mit Herzinsuffizienz oder chronischer Niereninsuffizienz sollten zunächst mit SGLT2-Inhibitoren oder bei Kontraindikationen mit einem GLP-1-Analogon therapiert werden [1].
- Prinzipiell ist auch eine Dreierkombination oraler Substanzen möglich, wobei es keine ausreichenden Daten für solche Kombinationen gibt.
- Eine Kombination von Metformin/SGLT2-Inhibitoren mit einem Inkretinmimetikum ist aufgrund der unterschiedlichen Therapieansätze möglich, wird derzeit aufgrund des hohen Preises der Inkretinmimetika allerdings eher selten praktiziert.
- Bei Unverträglichkeit von Metformin oder SGLT2-Hemmern können andere orale Antidiabetika verwendet werden, wobei es bzgl. dieser Substanzen bislang keine klaren Präferenzen von Seiten der Fachgesellschaften gibt. Am ehesten sind Sulfonylharnstoffe oder DPP-4-Hemmer in Betracht zu ziehen.
- Bei unzureichender HbA1c-Kontrolle soll eine Basalinsulintherapie oder eine rein prandiale Insulintherapie begonnen werden. Bei guter Adhärenz kann im weiteren Verlauf auf eine intensiviert konventionelle Insulintherapie, ggf. unter Fortführung der weiteren antidiabetischen Therapie, umgestellt werden.
- Biguanide: Das Metformin gilt als 1. Wahl für die orale antidiabetische Therapie und wird besonders durch seinen Gewichtsreduktionseffekt gerne bei übergewichtigen Diabetikern eingesetzt [3].
- Für Metformin wurde die Reduktion kardiovaskulärer Ereignisse und Mortalität gezeigt.
- Die Glukoneogenese der Leber wird gehemmt und dadurch, dass die Insulinsekretion nicht beeinflusst wird, besteht keine Gefahr der Hypoglykämie.
- Beachtet werden müssen die Kontraindikationen der schweren Niereninsuffizienz (GFR <30ml/min/1,73m2), Leberinsuffizienz, Herzinsuffizienz sowie der akuten Ischämie wegen der Gefahr der Laktatazidose.
- Ebenso sollte Metformin vor Kontrastmittelgabe oder geplanten Operationen abgesetzt werden.
- Die häufigsten Nebenwirkungen sind Diarrhöen und Meteorismus.
- Dosierung: zunächst 500mg zur Nacht, über 2–4 Wochen Steigerung auf 2×1000mg, sofern toleriert
- Sulfonylharnstoffe: Die gesteigerte Insulinsekretion basiert auf einer rezeptorvermittelten Schließung des ATP-abhängigen Kaliumkanals auf der Betazelle (Insulin-Sekretagoga).
- Als Nebenwirkung kann eine Hypoglykämie auftreten, obgleich diese recht selten ist.
- Bei langjährigem Diabetes und bereits erschöpfter Sekretionsfähigkeit der Betazellen ist die Wirkung eingeschränkt.
- Es gibt Hinweise, dass diese Substanzklasse das Risiko für mikrovaskuläre Ereignisse senken kann.
- Dosierung: z.B. Glimepirid 1mg, nach 1–2 Wochen Steigerung auf 2mg (max. 6mg/d)
- Thiazolidindione (Glitazone): Verbesserung der Insulinsensitivität
- Der einzige verbliebene Vertreter dieser Klasse ist das Pioglitazon.
- Nebenwirkungen sind periphere Ödeme, Anämie, Knochenfrakturen und Gewichtszunahme, Kontraindikationen sind Herzinsuffizienz und Knochenfrakturen bei postmenopausalen Frauen.
- Da keine Reduktion kardiovaskulärer Ereignisse und ein schlechtes Nutzen-Risiko-Verhältnis vorliegt, spielt die Anwendung von Pioglitazon derzeit praktisch keine Rolle.
- α-Glukosidase Hemmer: Sie hemmen die α-Glukosidase im Darm, wodurch es zu einer verzögerten Aufspaltung komplexer Kohlenhydrate und somit zu einem flacheren Glukoseanstieg kommt.
- Nebenwirkungen sind Meteorismus und Durchfälle.
- Eine Reduktion kardiovaskulärer Ereignisse wurde bislang nicht eindeutig bewiesen.
- Dosierung: z.B. Acarbose 1–3×tgl. 50mg, Dosissteigerung bei guter Verträglichkeit bis 300mg tgl. möglich
- Glinide: bewirken erhöhte Insulinsekretion
- Die Einnahme erfolgt aufgrund der kurzen Halbwertzeit direkt zu den Mahlzeiten.
- Es gibt keine überzeugenden Daten, dass die Glinide zusätzliche Vorteile gegenüber den Sulfonylharnstoffen besitzen.
- DPP-4-Inhibitoren (Gliptine): Die Hemmung der Dipeptidyl-Peptidase-4 verhindert einen Abbau der durch die Nahrungsaufnahme aus den L-Zellen des Ileums freigesetzten sog. Inkretine GLP-1 (Glucagon-like Peptide 1) oder GIP (glukoseabhängiges insulinotropes Peptid), die glukoseabhängig die Insulinsekretion steigern.
- Hypoglykämien oder Gewichtszunahme spielen keine Rolle.
- Eine Reduktion kardiovaskulärer Ereignisse im Vergleich zur Standardtherapie konnte nicht nachgewiesen werden, jedoch ist diese Substanzklasse auch nicht schlechter als eine Standardtherapie mit Metformin im Hinblick auf die Blutzuckerkontrolle.
- Dosierung: z.B. Sitagliptin 100mg 1×tgl., bei eingeschränkter Nierenfunktion (30ml/min/1,73m2 > GFR < 45ml/min/1,73m2) Halbierung der Dosis
- GLP-1-Analoga: inkretinmimetische Wirkung in Form von gesteigerter glukoseabhängiger Insulinsekretion, verzögerter Magenentleerung sowie zentraler Inhibierung des Hungergefühls
- guter Gewichtsreduktionseffekt, daher auch Zulassung zur adjuvanten Adipositastherapie
- Zu den Nebenwirkungen gehören initial Übelkeit und Erbrechen. Aber auch das Risiko von Pankreatitiden ist möglicherweise erhöht, ebenso wird eine Prädisposition zum Pankreas- und Gallengangskarzinom untersucht.
- deutliche Reduktion kardiovaskulärer Ereignisse, wodurch der inkretinbasierten Therapie ein hoher Stellenwert zukommt [4]
- Dosierung: z.B. Liraglutid 1,2mg s.c. 1×tgl. mit Dosissteigerung bei guter Verträglichkeit auf 1,8mg pro Tag
- SGLT2-Inhibitoren (Glukosuria): Hemmung des Glukosetransporter SGLT2 in den Nieren, dadurch verminderte Reabsorption von Glukose und gesteigerte Glukosurie.
- Die Nebenwirkungen liegen primär in vermehrtem Auftreten von Urogenitalinfekten. Nach anfänglicher Reduktion der Nierenfunktion scheinen die SGLT2 Inhibitoren eher nephroprotektiv zu wirken.
- Darüber hinaus kommt es zu einer Reduktion kardiovaskulärer Ereignisse [5].
- Vorsicht sollte bei Patienten mit diabetischem Fußsyndrom gelten, denn einige Daten belegen eine höhere Amputationsrate unter dieser Therapie.
- Auf ausreichende Hydratation sollte hingewiesen werden.
- gute Reduktion kardiovaskulärer Ereignisse und der kardiovaskulären Mortalität
- Dosierung: z.B. Empagliflozin 10mg 1×tgl., Steigerung auf 25mg möglich
| Merke Bei Patienten mit einem diabetischen Fußsyndrom sollte auf eine Therapie mit einem SGLT2-Hemmer verzichtet werden, da dies unter Umständen die Amputationsrate erhöhen kann. |
- Insulintherapie: Begonnen werden kann mit einer Basalinsulintherapie mit Langzeitinsulin oder auch einer rein prandialen Insulintherapie mit einem kurzwirksamen Insulin.
- Nebenwirkungen liegen primär in der Gefahr von Hypoglykämien und der Gewichtszunahme.
- Als Verzögerungsinsuline werden zumeist Neutrale-Protamin-Hagedorn-Insuline (NPH-Insuline) oder langwirksame Insulinanaloga verwandt.
- Normalinsulin oder schneller wirksamere Insulinanaloga werden als kurzwirksame Insuline eingesetzt.
- Bei der intensiviert-konventionellen Therapie (ICT) handelt es sich um ein kombiniertes Verfahren mit Basalinsulin und kurzwirksamem Insulin nach dem Basis-Bolus-Prinzip.
- Anpassung des kurzwirksamen Insulins nach Glukosewert, ggf. kann bei jungen adhärenten Patienten eine weitere Adjustierung der Dosis entsprechend der Kohlenhydrataufnahme erfolgen (mittels Broteinheiten-adaptierter Korrektur, ähnlich wie bei Typ 1 Diabetikern).
- Der Vorteil ist eine physiologischere Nachahmung der Insulinsekretion und dadurch bessere Glukosekontrolle.
- Der Nachteil liegt in einer höheren Hypoglykämiegefahr.
- Eine Insulinpumpentherapie wird bei Typ-2-Diabetes nur in Ausnahmefällen angewandt.
- Bei der konventionellen Therapie werden primär morgens und abends vor den Mahlzeiten Mischinsuline (fixe Mischung kurzwirksamer und Basalinsuline) gespritzt. Hier liegt das Verhältnis meist bei 25–40% kurzwirksamem und 60–75% Basalinsulin (Richtwert: abends ca. die Hälfte der morgendlichen Dosis).
Interventionelle Therapie
- Therapie des hyperosmolaren diabetischen Komas: Bei Patienten mit Diabetes mellitus Typ 2 geht das diabetische Koma zumeist mit sehr hohen Glukosewerten einher. Eine Ketoazidose mit pH-Verschiebung wie bei Typ 1 Diabetikern tritt in der Regel nicht auf.
- Die Letalität des hyperosmolaren diabetischen Komas ist ca. 15% höher als beim ketoazidotischen Koma, was u.a. auf die durchschnittlich ältere Patientenklientel zurückzuführen ist.
- Therapie: hämodynamische und metabolische Stabilisierung mit ausreichender Flüssigkeitszufuhr, da das hypersomolare Koma stets mit einem schweren Flüssigkeitsdefizit einhergeht.
- Faustregel: in den ersten 2 bis 3 Stunden ca. 2 bis 3 Liter isotonische Kochsalzlösung intravenös. Der Gesamtbedarf an Flüssigkeitssubstitution liegt bei durchschnittlich 9–10l, sodass die Flüssigkeitssubstitution gesteuert nach Serumelektrolyten und klinischen Zeichen der Dehydratation über 1–2 Tage fortgeführt werden sollte (z.B. 200–300ml/h).
- Elektrolyte: auf Kalium und Magnesium achten, ggf. substituieren. Eine Hypophosphatämie wird zumeist durch Wiederaufnahme der Nahrungszufuhr beseitigt.
- Im Verlauf kann dann eine Insulintherapie begonnen werden, ggf. auch zunächst intravenös.
Operative Therapie
- bariatrische (metabolische) Chirurgie zur potenziell kurativen Therapie des Diabetes mellitus Typ 2
- Die Indikationsstellung orientiert sich an den Richtlinien der bariatrischen Chirurgie zur Therapie der Adipositas bei BMI>40kg/m2 oder BMI>35kg/m2 mit Begleiterkrankungen (z.B. Diabetes mellitus Typ 2).
- Der Effekt der metabolischen Chirurgie auf den Diabetes mellitus Typ 2 auch bei Patienten mit niedrigerem BMI (27–35kg/m2) wird untersucht.
- Je nach Dauer des Diabetes und je nach OP-Verfahren ergeben sich Remissionsraten bis zu 80–85%.
- Die effektivste Operationsmethode zur dauerhaften Remission ist der Magenbypass.
- Je länger der Diabetes jedoch besteht, desto geringer sind die Remissionsraten.
- Auch der Schlauchmagen (Sleeve-Gastrektomie) zeigt gute Ergebnisse.
- Die chirurgische Therapie verhindert kardiovaskuläre Ereignisse und Todesfolge des Diabetes mellitus Typ 2.
Nachsorge
- Nachsorge spielt vor allem nach metabolisch/bariatrischer Chirurgie eine wichtige Rolle. Gerade die hohen Remissionsraten nach metabolischer/bariatrischer Chirurgie erfordern häufig eine Therapieanpassung.
- Bei langjährigem Diabetes muss auch nach Remission darauf geachtet werden, dass Sekundärkomplikationen trotz guter Glukosekontrolle über Jahre weiter voranschreiten können. Eine fortgeführte Kontrolle der Nierenfunktion, des Augenhintergrunds, der Nervenfunktion sowie der Gefäßintegrität ist obligat.
Verlauf und Prognose
- Die Entstehung des Diabetes mellitus Typ 2 ist gewöhnlich ein Prozess, der über Jahre/Jahrzehnte voranschreitet und unbehandelt zu einer deutlich reduzierten Lebenserwartung führt. Dies liegt insbesondere an mikro- sowie makrovaskulären Komplikationen.
- Neben Metformin können neue Antidiabetika, z.B. GLP-1-Analoga oder auch SGLT2-Inhibitoren diese vaskulären Komplikationsfolgen sowie auch die Todesraten senken.
- Trotzdem starben im Jahr 2015 ca. 1,6 Mio. Menschen an den direkten Folgen des Diabetes mellitus Typ 2.
- Damit ist diese Erkrankung laut WHO die siebthäufigste Todesurachse weltweit.
- Die Remissionsraten unter konservativer Therapie und/oder Pharmakotherapie sind gering. Im Gegensatz dazu erzielt die metabolische/bariatrische Chirurgie bei adipösen Patienten gute Erfolge und wird vermutlich in naher Zukunft eine eher größere Rolle in der Therapie des Diabetes mellitus Typ 2 einnehmen.
Prävention
- Die Prävention des Diabetes mellitus Typ 2 basiert auf Aufklärung und Schulung der Betroffenen über gesunde Ernährungsweisen, ausreichende Bewegung und deren Konsequenzen in der Zukunft.
- Für eine populationsbezogene Prävention liegt ein zentraler Ansatzpunkt in den Schulen und der Vermittlung gesunder Lebensweisen inklusive sportlicher Betätigung für Kinder und Jugendliche.
- Politische Ansätze zur Besteuerung „gesundheitsschädlicher“ Nahrungsmittel werden diskutiert.
Literatur
Quellenangaben
-
[1] Davies MJ, D’Alessio DA, Fradkin J et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologica 2018; 61: 2461–2498
Suche in: PubMed Google Scholar -
[2] Davies MJ, D’Alessio DA, Fradkin J et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2018 Dec; 41(12): 2669–2701
Suche in: PubMed Google Scholar -
[3] Holman RR, Paul SK, Bethel MA et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Eng J Med 2008; 959: 1577–1589
Suche in: PubMed Google Scholar -
[4] Marso SP, Daniels GH, Brown-Frandsen K et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016; 375: 311–322
Suche in: PubMed Google Scholar -
[5] Zinman B, Wanner C, Lachin JM et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015; 373: 2117–2128
Suche in: PubMed Google Scholar
Wichtige Internetadressen
-
Nationale Versorgungsleitlinie „Therapie des Diabetes mellitus Typ 2“ Version 3. Im Internet: http://www.diabetes.versorgungsleitlinien.de; Stand: 31.07.2019